Dalam reaksi kimia tentu melibatkan berbagai senyawa dengan susunan komposisi atom yang berbeda-beda. Untuk menyatakan komposisi atom penyusun senyawa maka dibutuhkan rumus kimia. Rumus kimia senyawa sendiri dibedakan menjadi dua jenis yakni rumus empiris dan rumus molekul.
Pengertian Rumus Empiris dan Rumus Molekul
Rumus kimia berfungsi untuk memudahkan para ilmuwan dalam menyatakan komposisi atom yang menyusun berbagai senyawa di muka bumi. Setiap senyawa kimia memiliki tata penulisan berbeda begitu pula karakteristik senyawa tersebut.
Oleh karena itu setiap rumus kimia memiliki nama dengan seperangkat aturan yang sudah ditetapkan dan disebut sebagai tata nama senyawa. Rumus kimia suatu zat akan membantu ilmuwan dalam menuliskan zat apa saja yang bereaksi termasuk hasil reaksinya pada suatu persamaan reaksi.
Rumus kimia sendiri dibedakan menjadi rumus empiris dan rumus molekul. Rumus empiris sebuah senyawa merupakan rumus yang digunakan untuk menuliskan perbandingan paling kecil dari jumlah atom-atom unsur penyusun senyawa.
Sementara rumus molekul suatu senyawa adalah rumus yang digunakan untuk menyatakan jumlah atom yang sebenarnya yang ada di dalam molekul senyawa tersebut. Rumus molekul bisa saja sama penulisannya dengan rumus empiris.
Rumus empiris senyawa bisa sama dengan rumus molekul apabila perbandingan jumlah atom pada rumus molekul adalah perbandingan paling sederhana. Beberapa senyawa yang mempunyai rumus empiris sama dengan rumus molekul adalah H2O, NH3, H2SO4.
Rumus empiris lebih umum digunakan untuk menunjukkan rumus kimia senyawa-senyawa ion seperti natrium klorida dituliskan dengan rumus kimia NaCl. Senyawa NaCl memiliki perbandingan ion Na+ dan Clˉ = 1 : 1. Sementara asam sulfat berumus kimia H2SO4 memiliki perbandingan ion H+ dan SO4²ˉ = 2 : 1.
Senyawa ion terdiri dari ion negatif dan ion positif. Senyawa ion sendiri tidak bermuatan karena jumlah muatan negatif sama dengan jumlah muatan positifnya. Sebagai contoh pada senyawa CaCl2 terdiri dari 1 buah ion Ca²+ dengan 2 buah ion Clˉ sehingga total muatannya adalah +2 + (-2) = 0.
Jumlah Atom pada Rumus Kimia
Seperti yang sudah diketahui bahwa rumus kimia terdiri dari rumus empiris dan rumus molekul. Rumus empiris lebih sederhana dibandingkan rumus molekul karena rumus empiris terdiri dari angka yang menyatakan perbandingan terkecil dari jumlah atom unsur penyusun senyawa.
Namun, karena rumus empiris adalah bentuk rumus molekul yang sudah disederhanakan, maka tidak bisa diketahui jumlah asli dari atom-atom penyusun senyawa tersebut. Sehingga untuk mengetahui jumlah masing-masing atom dilakukan dengan melihat rumus molekul untuk senyawa tersebut.
Ada beberapa hal yang harus diperhatikan untuk menentukan jumlah masing-masing atom pada senyawa:
- Jumlah atom pada rumus kimia dapat dilihat dari tulisan angka yang ada di belakang lambang atom, sebagai contoh pada senyawa CO2, maka jumlah atom karbon C = 1 dan atom O =2
- Terkadang senyawa ion dituliskan dengan menyertakan tanda kurung, Sebagai contoh pada senyawa CO(NH2) 2 atau senyawa urea. Pada rumus kimia ini, angka yang ada di luar kurung menyatakan jumlah gugus atom yang ada di dalam kurung.
Sehingga jumlah masing-masing atom pada senyawa urea CO(NH2)2 adalah C = 1, O = 1, N = 1 x 2 = 2, H = 2 x 2 = 4. Untuk semakin memudahkan pemahaman terkait jumlah atom pada rumus kimia, lihat tabel jumlah atom beberapa senyawa di bawah ini.
| Rumus Kimia | Jumlah Setiap Atom |
| K2SO4 | Atom K = 2, atom S = 1, atom O = 4 |
| Ca(OH) 2 | Atom Ca = 1, atom O = 2, atom H = 2 |
| Al2 (SO4) 3 | Atom Al = 2, atom S = 3, atom O = 12 |
| Ba3(PO4) 2 | Atom Ba = 3, atom P = 2, atom O = 8 |
| Fe(OH) 3 | Atom Fe = 1, atom O = 3, atom H = 3 |
| MgBr2 | Atom Mg = 1, atom Br = 2 |
Cara Menentukan Rumus Empiris dan Rumus Molekul
- Menentukan Rumus Empiris Senyawa
Rumus empiris suatu senyawa bisa ditentukan dengan cara menghitung mol dari masing-masing komponen penyusun zat menggunakan massa molar zat tersebut. Untuk menentukan rumus empiris senyawa, maka perbandingan mol dari setiap unsur zat harus merupakan perbandingan paling sederhana.
Rumus untuk menghitung mol komponen zat:
n = m/Ar
Keterangan:
n = jumlah molalitas atom (mol unsur)
m = massa atom (gram)
Ar = massa molekul relative atom (g/mol)
Sebagai contoh suatu zat memiliki 4,8 gram atom O dan 11,2 gram atom Fe. Tentukan bentuk rumus empiris dari senyawa tersebut (Diketahui Ar O = 16 gram/mol dan Ar Fe = 56 gram/mol)
Jawab:
Untuk bisa mendapatkan rumus empiris zat yang terdiri dari atom Fe dan O dengan menghitung perbandingan mol terlebih dulu:
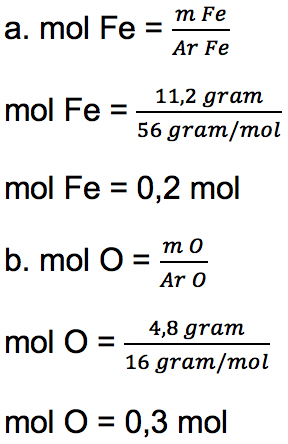
Sehingga perbandingan Fe : O adalah 0,2 : 0,3 = 2 : 3. Rumus empiris senyawa dari atom-atom di atas adalah Fe2O3.
- Menentukan Rumus Molekul Senyawa
Rumus molekul senyawa bisa ditentukan apabila rumus empiris senyawa serta massa molekul relative (Mr) dari zat tersebut diketahui.
(rumus empiris)n = rumus molekul
Mr rumus molekul = n x (Mr rumus empiris)
Contoh Soal Rumus Empiris dan Rumus Molekul
- Soal
Tentukan rumus empiris dari zat cita rasa vanilla dalam makanan yang terdiri dari komposisi unsur O 31,6%, unsur H 5,2%, unsur C 63,2%. Diketahui massa molekul relative atom (Ar) O = 16, H = 1 dan C = 12.
Jawab:
Apabila diketahui persen massa dari unsur penyusun zat, maka untuk mengetahui rumus empiris dengan menghitung perbandingan mol dalam 100 gram sampel vanilla.
a. Unsur O
% massa = 31,6
Massa per 100 gram = 31,6% x 100 gram = 31,6 gram
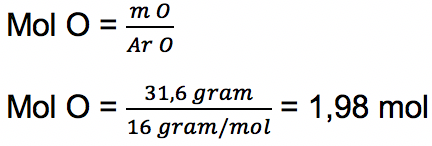
b. Unsur H
% massa = 5,2
Massa per 100 gram = 5,2% x 100 gram = 5,2 gram
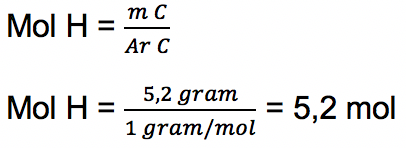
c. Unsur C
% massa = 63,2
Massa per 100 gram = 63,2% x 100 gram = 63,2 gram
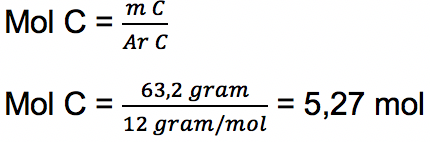
Kesimpulan
Rumus empiris dan rumus molekul zat termasuk rumus kimia yang digunakan untuk menunjukkan jumlah atom di dalam molekul senyawa. Rumus molekul dapat menunjukkan jumlah atom yang sebenarnya sementara rumus empiris yaitu rumus yang menunjukkan perbandingan terkecil dari atom unsur senyawa.
