Setiap senyawa kimia tentunya mempunyai komposisi tertentu yang mempengaruhi reaksi kimia yang dialami termasuk perbandingan pencampuran senyawa tersebut. Sehingga dibutuhkan ilmu yang mempelajari hubungan antara setiap senyawa yang terlibat pada reaksi kimia yakni stoikiometri.
Definisi Stoikiometri
Istilah stoikiometri bersumber dari bahasa Yunani yakni dari kata stoicheion yang memiliki makna unsur, serta metron yang memiliki makna mengukur. Sehingga stoikiometri bisa diartikan sebagai perhitungan kimia.
Ada berbagai konsep yang mendasari perhitungan kimia seperti rumus kimia, massa atom relative, konsep mol dan persamaan reaksi. Memahami materi stoikiometri sangat dibutuhkan dalam aktivitas yang melibatkan zat-zat kimia dan pencampurannya sehingga bisa dihasilkan produk yang tepat.
Di dalam materi Kimia terdapat beberapa hukum dasar yang harus dipahami yakni Hukum Kekekalan Massa (Lavoisier), Hukum Perbandingan Tetap (Proust), Hukum Kelipatan Perbandingan (Dalton) dan Hukum Perbandingan Volume (Gay Lussac).
Hukum Kekekalan Massa (Hukum Lavoisier)
Saat berlangsungnya reaksi kimia maka terjadi pemutusan ikatan-ikatan pada zat pereaksi yang kemudian terjadi pembentukan ikatan lagi pada zat-zat hasil reaksi. Saat terjadi pemutusan ikatan pada zat pereaksi tersebut, maka yang menjadi pertanyaan adalah kondisi massa zat pada reaksi tersebut.
Untuk mengetahui bagaimana kondisi massa zat pada reaksi, maka para ahli kimia melakukan berbagai percobaan. Hingga pertengahan abad ke-18 para ahli kimia berpikir bahwa sebagian massa zat setelah reaksi berlangsung menghilang. Sesuatu yang menghilang itu disebut sebagai “flogiston” oleh para ahli.
Namun teori ini dihapuskan sejak ilmuwan Prancis Antoine Lavoisier menemukan fenomena kekekalan massa yang diterbitkan pada buku berjudul Traite Elementaire de Chemie. Lavoisier menjelaskan bahwa reaksi kimia yang terjadi di tempat tertutup maka tidak ada hasil reaksi yang keluar dari tempat tertutup.
Kesimpulan hukum kekekalan massa yakni jumlah massa zat sebelum reaksi kimia dan setelah reaksi kimia selalu bernilai sama”.
Hukum Perbandingan Tetap (Hukum Proust)
Ilmuwan kimia Joseph Louis Proust di tahun 1799 mengemukakan satu sifat yang penting pada senyawa yang dinamakan sebagai hukum perbandingan tetap. Saat melakukan penelitian, Proust menyimpulkan bahwa perbandingan dari massa unsur pada satu senyawa nilainya tertentu dan juga tetap.
Penelitian Proust menunjukkan bahwa untuk senyawa yang sama meski diteliti dari daerah dan dengan cara pembuatan yang berbeda akan menghasilkan komposisi yang sama. Contoh pada massa garam dapur yang terdiri dari unsur natrium dan klorida, berapapun massa garamnya maka perbandingan Na : Cl sama.
Hukum perbandingan tetap berbunyi bahwa perbandingan dari massa masing-masing unsur pada suatu senyawa bernilai tetap.”
Hukum Perbandingan Berganda (Hukum Dalton)
Beberapa unsur bisa membentuk suatu senyawa dalam berbagai perbandingan seperti unsur karbon (C) dengan unsur oksigen (O) bisa membentuk karbon dioksida dan karbon monoksida yang memiliki rumus CO2 dan CO. Jika dibuat dalam suatu tabel perbandingan massa oksigen pada senyawa CO2 dan CO:
| Rumus Senyawa | Massa Senyawa | Massa Unsur pada Senyawa Karbon | Massa Unsur pada Senyawa Oksigen |
| CO2 | 3,66 gram | 1 gram | 2,66 gram |
| CO | 2,33 gram | 1 gram | 1,33 gram |
Bisa dilihat pada tabel di atas bahwa perbandingan massa oksigen yang terikat oleh unsur karbon dengan massa yang sama adalah 1 : 2. Dari penelitiannya ini, Dalton kemudian merumuskan teorema Hukum Dalton berikut:
“Dua senyawa yang terdiri dari 2 unsur yang sama dengan massa salah satu unsurnya pada kedua senyawa itu sama akan membuat massa unsur lainnya mempunyai angka perbandingan bulat sederhana.”
Persamaan pada hukum perbandingan Dalton sebagai berikut:
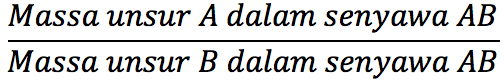
Hukum Perbandingan Volume (Hukum Gay Lussac)
Selain perbandingan massa dalam reaksi yang nilainya sama dan dinyatakan dengan bilangan bulat sederhana, perbandingan volume gas-gas dalam reaksi ternyata juga selalu merupakan bilangan bulat sederhana.
Hal ini dinyatakan oleh Joseph Gay Lussac di tahun 1808 yang melakukan percobaan terhadap berbagai macam gas terhadap gas hidrogen. Percobaan Gay Lussac dapat dituliskan dalam persamaan reaksi di bawah ini:
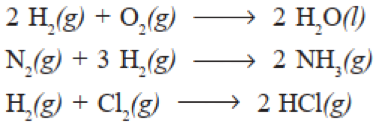
Bunyi hukum perbandingan volume rumusan Gay Lussac:
“Volume masing-masing gas yang bereaksi serta volume dari gas hasil reaksi memiliki perbandingan bilangan bulat sederhana pada tekanan serta suhu yang sama,.”
Bisa disimpulkan pada hukum perbandingan volume Gay Lussac bahwa perbandingan volume setiap gas akan sesuai dengan koefisien dari masing-masing gas. Misal terdapat dua gas yakni gas A dan gas B berlaku relasi:

Hipotesis Avogadro
Alasan mengapa perbandingan volume gas-gas dalam sebuah reaksi kimia selalu merupakan bilangan bulat sederhana tidak bisa dijelaskan oleh Dalton dan Gay Lussac. Alasan perbandingan volume gas selalu merupakan bilangan bulat sederhana baru dapat dijelaskan oleh Amedeo Avogadro di tahun 1811.
Avogadro menyatakan bahwa partikel unsur tidak selalu berupa atom tunggal (monoatomik) namun bisa berbentuk 2 atom (diatomic) bahkan lebih dari dua atom (poliatomik). Hipotesis Avogadro berbunyi:
“Pada tekanan serta suhu yang sama, seluruh gas dengan volume yang sama mengandung jumlah molekul yang sama pula”
Bisa dikatakan bahwa perbandingan volume gas yang bereaksi sama dengan koefisien dari reaksi kimia.
Contoh Soal Stoikiometri
- Soal 1
Diketahui perbandingan massa karbon terhadap massa oksigen pada suatu senyawa karbon dioksida (CO2) adalah 3 : 8. Tentukan berapa sisa pereaksi dan berapa gram massa karbon dioksida yang terbentuk apabila direaksikan 9 gram karbon dan 24 gram oksigen.
Jawab:
| Langkah-Langkah | Massa Karbon (C) | Massa Oksigen (O) | Massa CO2 terbentuk | Massa Sisa |
| Awal | 9 gram | 24 gram | – | – |
| Perbandingan massa | 9/3 = 3 | 24/8 = 3 | ||
| Zat yang bereaksi | 3 x 3 = 9 | 3 x 8 = 24 | 9 + 24 = 33 gram | |
| Zat sisa | 9 – 9 = 0 gram | 24 – 24 = 0 gram | 0 |
- Soal 2
Pada senyawa CO dan CO2 memiliki perbandingan massa O dan C sebagai berikut:
| Rumus Senyawa | Massa Unsur pada Senyawa Karbon | Massa Unsur pada Senyawa Oksigen |
| CO2 | 28 gram | 64 gram |
| CO | 21 gram | 24 gram |
Tentukan apakah kedua rumus senyawa di atas memenuhi Hukum Kelipatan Perbandingan!
Jawab:
Apabila massa C pada senyawa CO disamakan dengan massa C pada CO2 yakni 28, maka massa O pada CObisa dihitung menggunakan rumus berikut:
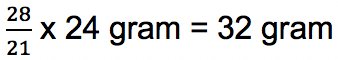
Apabila dibuat perbandingan massanya menjadi:
| Rumus Senyawa | Massa Unsur pada Senyawa Karbon | Massa Unsur pada Senyawa Oksigen |
| CO2 | 28 gram | 64 gram |
| CO | 28 gram | 32 gram |
Dilihat dari perbandingan di atas maka untuk perbandingan massa C yang sama maka perbandingan massa oksigennya adalah CO : CO2 = 32 : 64 = 1 : 2 yang merupakan bilangan sederhana dan bulat.
Kesimpulan
Stoikiometri adalah konsep dalam mempelajari hubungan antara zat-zat yang terlibat pada suatu reaksi kimia, baik itu produk atau hasil reaksi dan reaktannya. Dengan memahami hukum dasar dalam stoikiometri maka bisa dihitung volume massa reaktan yang diperlukan untuk menghasilkan sejumlah massa produk.
