Pada tahun 1834, seorang ilmuwan bernama Michael Faraday merumuskan suatu hukum terkait hubungan antara arus listrik yang dialirkan ke dalam larutan dengan banyaknya zat kimia yang dihasilkan. Percobaan dari Michael Faraday ini kemudian menghasilkan Hukum Faraday I dan Hukum Faraday II.
Hukum Faraday I
Michael Faraday melakukan penelitian mengenai fenomena elektrolisis dan menemukan fakta bahwa perubahan kimia yang dihasilkan dari arus listrik nilainya berbanding lurus dengan jumlah arus listrik yang dilewatkan. Saat fakta ini diketahui, sifat dasar elektron sendiri belum diketahui.
Michael Faraday kemudian menyimpulkan fakta yang diperoleh ini dengan menamakannya Hukum Faraday yakni “Jumlah massa zat yang terbentuk atau terlarut selama reaksi elektrolisis nilainya berbanding lurus dengan total arus listrik yang dialirkan lewat sel elektrolisis.”
Dalam satu mol elektron terkandung muatan sebanyak 96.500 Coulomb. Jumlah muatan listrik ini dinamakan satu Faraday sehingga disimpulkan bahwa 1 Faraday = 96.500 Coulomb. Muatan listrik sebanyak 1 Faraday bisa mengandapkan sebanyak 1 gram ekuivalen.
Untuk menghitung massa zat yang dihasilkan dari reaksi elektrolisis yang terbentuk di anode dan katode menggunakan rumus berikut ini:
m = e x F
Keterangan:
m = massa zat yang dihasilkan dari reaksi elektrolisis (gram)
e = Ar/n = massa ekuivalen zat yang dihasilkan dari reaksi elektrolisis
F = Jumlah muatan listrik dalam satuan Faraday
n = mol elektron yang ada pada reaksi
Apabila nilai 1 Coulomb setara dengan 1 Ampere detik, maka untuk menghitung massa zat yang dihasilkan dari reaksi elektrolisis bisa menggunakan persaman berikut ini:
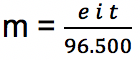
Keterangan:
t = lama terjadinya elektrolisis (detik)
i = arus yang mengalir (Ampere)
Arus listrik memiliki nilai yang sama dengan perbandingan antara muatan (Q) dengan waktu (t), sehingga rumus di atas bisa diubah menjadi:
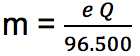
Keterangan:
Q = muatan listrik
Q = i x t
Hukum Faraday II
Hukum Faraday kedua berbunyi bahwa total zat yang diperoleh dari arus yang sama di dalam beberapa sel berbeda nilainya akan berbanding lurus terhadap berat ekuivalen dari zat-zat tersebut. Hukum Faraday II apabila dibuat dalam bentuk persamaan seperti berikut ini:
m1 : m2 = e1 : e2
Keterangan:
m1 = massa dari zat terendap ke-1
m2 = massa dari zat terendap ke-2
e1 = massa ekuivalen dari zat ke-1
e2 = massa ekuivalen dari zat ke-2
Hukum Faraday memiliki manfaat sangat besar dalam membantu proses elektrolisis di bidang industri seperti pembuatan zat kimia klor-alkali. Elektrolisis klor-alkali adalah proses produksi soda api (natrium hidroksida) dan klor dari air asin seperti air laut yang mengandung senyawa natrium klorida.
Contoh Soal Hukum Faraday
- Soal 1
Jika pada larutan Co(NO3)2 mengalir padanya arus listrik sebanyak 0,3 Ampere dan mengalir selama 3 jam, tentukan berapakah massa dari logam Kobalt (Co) yang mengendap? Diketahui nilai Ar O=16, Co = 59, N = 14.
Jawab:
Co²+ (aq) + 2 eˉ → Co (s)
e Co = Ar : valensi
e Co = 59 : 2 = 29,5
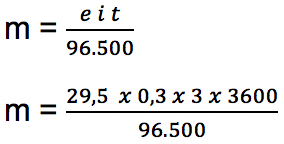
m = 0,99 gram
- Soal 2
Jika pada larutan AgNO3 dialiri arus listrik sebanyak 15 Ampere dan mengalir selama 1,5 jam, tentukan berapakah massa dari logam perak (Ag) yang mengendap? Diketahui nilai Ar Ag = 108.
Jawab:
Ag+ (aq) + eˉ → Ag (s)
e Ag = Ar : valensi
e Ag = 108 : 1 = 108
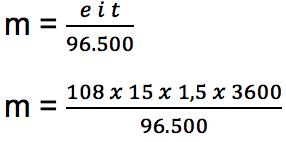
m = 90,65 gram
- Soal 3
Larutan AgNO3 dan larutan CuSO4 dialiri sejumlah arus listrik. Apabila jumlah logam perak yang terendap sebesar 23,5 gram, tentukan berapa banyak logam tembaga yang mengendap? Diketahui Ar Cu = 63,5 dan Ar Ag = 108
Jawab:
Ag+ (aq) + eˉ → Ag (s)
Cu²+ (aq) + 2 eˉ → Cu (s)
e Ag = Ar Ag : valensi
e Ag = 108 : 1 = 108
e Cu = Ar Cu : valensi
e Cu = 63,5 : 2 = 31,75
m Ag : m Cu = e Ag : e Cu
23,5 : m Cu = 108 : 31,75
m Cu = 6,91 gram
- Soal 4
Pada reaksi elektrolisis leburan Al2O3 dihasilkan Al sebanyak 0,345 gram. Diketahui Ar O = 16 dan Al = 27. Tentukan:
a. Berapa muatan listrik yang dibutuhkan untuk menjalankan reaksi elektrolisis tersebut (F = 96.500 C)
b. Waktu yang dibutuhkan pada proses elektrolisis apabila arus listrik yang mengalir sebesar 1 Ampere
Jawab:
a. Al³+ (aq) + 3 eˉ → Al (s), sehingga n = 3
e Al = Ar Al : n
e Al = 27 : 3 = 9
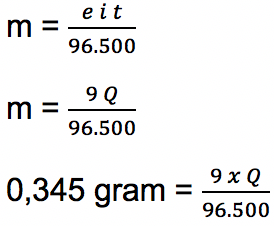
Q = 3699,167 Coulomb
Sehingga muatan listrik yang dibutuhkan yakni sebesar 3.699,167 Coulomb
b. Untuk menghitung waktu yang dibutuhkan dalam proses elektrolisis, maka digunakan persamaan berikut:
Q = i x t
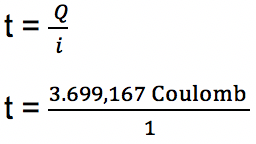
t = 3.699,167 sekon atau sekitar 62 menit
- Soal 5
Sejumlah arus listrik bisa mengendapkan logam perak sebanyak 0,72 gram dari larutan perak nitrat. Arus listrik yang sama juga bisa mengendapkan sebanyak 0,44 gram logam B dari larutan BCl3. Tentukan berapakah massa atom relative B? Diketahui Ar Ag = 108.
Jawab:
Larutan perak nitrat AgNO3 yang dialiri listrik kemudian menghasilkan endapan logam Ag sebanyak 0,72 gram.
Ag+ (aq) + eˉ → Ag (s) sehingga nilai n = 1
e Ag = Ar Ag : n = 108 : 1 = 108
Larutan BCl3 menghasilkan endapan logam B yang memiliki valensi sebesar:
B³+ (aq) + 3 eˉ → B (s) sehingga nilai n = 3
e B = Ar B : n = Ar B : 3
Maka massa atom relative B bisa dihitung dengan menggunakan persamaan Hukum Faraday II:
m Ag : m B = e Ag : e B
0,72 gram : 0,44 gram = 108 : e B
e B = 66
Maka massa atom relative logam B dihitung dengan rumus berikut:
66 = Ar B : 3
Ar B = 198
Penutup
Hukum Faraday sangat bermanfaat untuk menghitung jumlah zat yang mengendap pada elektrode. Faraday sendiri merupakan ilmuwan yang pertama kali menjelaskan adanya hubungan kuantitatif antara banyaknya arus listrik yang dialirkan pada elektrolisis dengan hasil elektrolisis yang merupakan hasil kimia.
