Korosi atau pengkaratan pada logam menjadi momok yang paling mengerikan bagi para teknisi ataupun pada pemilik mesin dan material berbahan logam seperti besi. Korosi pada logam sangat berbahaya apabila dibiarkan karena bisa menyebabkan struktur logam menjadi keropos dan tidak lagi kokoh.
Pengertian Korosi
Korosi adalah proses rusaknya benda khususnya logam yang disebabkan oleh reaksi elektrokimia dari logam tersebut dengan lingkungannya. Contohnya adalah proses pengkaratan besi dan logam.
Proses pengkaratan pada logam atau besi memang sulit untuk dicegah secara sempurna terutama apabila logam berada di tempat dengan kelembaban udara tinggi, sering terkena zat elektrolit dan faktor lainnya. Namun saat ini ilmuwan telah menemukan beberapa cara menghambat atau mencegah pengkaratan besi.
Proses Terjadinya Korosi
Ketika logam bersinggungan dengan oksigen atau bersinggungan dengan jenis logam lainnya di dalam lingkungan dengan kelembaban tinggi akan terbentuk sel elektrokimia yang mana logam yang mempunyai nilai E⁰ red lebih kecil sebagai anode dengan E⁰ red yang lebih besar sebagai katode.
Logam yang berperan sebagai anode mengalami korosi karena terjadi reaksi oksidasi. Tatkala besi yang terpapar udara secara langsung dapat berkarat, maka besi harus dilapisi seng sehingga seng tersebut yang mengalami korosi sementara jika besi dilapisi oleh timah putih maka besi tersebut mengalami korosi.
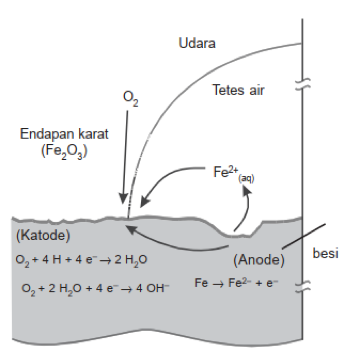
Reaksi besi yang berada di udara di bawah ini dengan mempertimbangkan potensial reduksi dari Fe dan O2.
Fe²+ (s) + 2 eˉ → Fe (s) E⁰ red = -0,44 Volt
O2 (g) + 4 H+ (aq) + 4 eˉ → 2 H2O (l) E⁰ red = +1,23 Volt
Jika dilihat nilai E⁰ red, maka nilai E⁰ red Fe < E⁰ red O2 maka Fe menjadi anode serta mengalami pengkaratan. Reaksi pengkaratan pada logam besi digambarkan pada Gambar 2 di bawah ini:
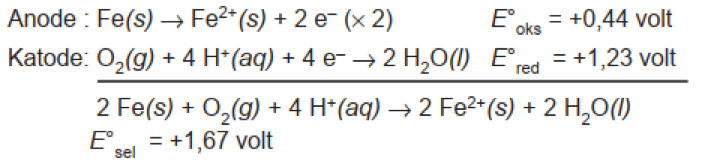
Nilai E⁰ sel > 0 sehingga reaksi korosi berjalan secara spontan bahkan reaksi korosi akan bereaksi lebih lanjut dan membentuk karat di logam besi:
4 Fe²+ (s) + O2 (g) + 4 H2O (l) + 2 x H2O (l) → 2 Fe2O3 (s) x H2O (s) + 8 H+ (aq)
Faktor yang Mempengaruhi Korosi Besi
Korosi yang terjadi pada logam seperti besi disebabkan oleh beberapa faktor sebagai berikut:
- Oksigen
Oksigen memiliki peran yang sangat besar terhadap terjadinya korosi terutama korosi besi. Pada proses perkaratan besi, oksigen akan mengalami reaksi reduksi di bagian besinya yang berperan sebagai katoda.
Sehingga disimpulkan apabila semakin banyak oksigen di suatu tempat maka akan semakin cepat korosi pada besi di tempat tersebut.
- Zat Elektrolit
Zat asam dan zat garam seperti air laut termasuk ke dalam jenis zat elektrolit yang dapat mempercepat proses korosi pada logam. Zat asam contohnya terdapat pada air hujan yang berasal dari hujan asam akibat reaksi antara belerang atau sulfur dan nitrogen di udara yang bereaksi dengan oksigen.
Reaksi antara sulfur dan nitrogen dengan oksigen membentuk nitrogen oksida serta sulfur dioksida. Kedua senyawa ini tinggal di atmosfer dan kemudian bereaksi dengan kelembaban udara sehingga menghasilkan hujan asam.
- Air dan Kelembapan Udara
Air sangat berpengaruh terhadap terjadinya korosi pada logam. Tatkala logam terlalu sering terpapar air termasuk udara dengan kandungan uap air tinggi yang dikenal sebagai kelembaban udara akan mempercepat proses pengkaratan pada logam.
Oleh karena itu di beberapa lokasi seperti industri hingga laboratoium penelitian berusaha mengalirkan udara yang kering untuk menghindari terjadinya korosi atau pengkaratan.
- Sel Elektrokimia
Sel elektrokimia bisa terbentuk saat ada dua atau lebih logam dengan potensial elektroda berbeda saling bersentuhan satu dengan yang lainnya.
Saat sel elektrokimia berada di tempat yang relative lembab maka logam dengan potensial elektrodanya lebih kecil akan lebih cepat mengalami korosi atau akan mudah teroksidasi oleh oksigen di udara.
- Permukaan Logam
Permukaan logam adalah salah satu faktor yang berpengaruh terhadap proses korosi logam. Permukaan logam yang lebih rata akan relatif lebih tahan terhadap perkaratan atau korosi. Sementara permukaan logam yang lebih kasar relative akan lebih mudah mengalami proses pengkaratan atau korosi.
Hal ini dapat dijelaskan secara teoritis bahwa logam dengan permukaan yang kasar akan memungkinkan terbentuknya kutub-kutub muatan. Kutub akan bertindak sebagai elektroda katoda dan elektroda anoda sehingga akan terjadi reaksi redoks yang menyebabkan korosi.
Sebaliknya, pembentukan kutub muatan tidak terjadi pada permukaan logam yang rata.
Cara-Cara untuk Mencegah Korosi Pada Logam
Terjadinya pengkaratan atau korosi pada logam hampir tidak bisa dihindari terutama pada logam yang sering terpapar air atau udara lembab. Tapi, ada beberapa cara yang bisa dilakukan untuk memperlambat atau menghambat pengkaratan pada logam seperti besi dengan perlindungan mekanis dan elektrokimia:
- Perlindungan Mekanis
Perlindungan mekanis biasa diberikan pada logam agar tidak mudah berkarat dengan cara mencegah logam tersebut bersentuhan langsung dengan udara. Contoh perlindungan mekanis yang mudah adalah mengoleskan lemak di permukaan logam. Cara ini cocok untuk jangka waktu pendek.
Sementara perlindungan untuk waktu lama maka bisa dilakukan cara pengecatan. Cat pelindung yang baik untuk logam adalah meni (Pb3O4) karena tidak hanya bisa melindungi secara mekanis namun juga memberi perlindungan elektrokimia.
Proses penyepuhan dengan logam lain juga bisa dilakukan sebagai perlindungan mekanis. Untuk melakukan penyepuhan, maka harus diperhatikan nilai E⁰ dari logam yang melindungi dan logam yang dilindungi, syaratnya adalah:
- Logam pelindung harus mempunyai nilai E⁰ lebih kecil dari E⁰ logam yang dilindungi
Dengan nilai E⁰ lebih kecil, maka logam pelindung bertindak sebagai anode pada “Sel volta mini” yang terbentuk sehingga logam yang dilindungi tidak akan teroksidasi selama logam pelindungnya masih ada.
- Perlindungan Elektrokimia
Perlindungan elektrokimia adalah cara perlindungan logam dengan mencegah terjadinya korosi elektrolitik, yakni reaksi elektrokimia yang dapat mengoksidasi logam. Perlindungan elektrokimia dikenal sebagai perlindungan anode (anodaising) dan perlindungan katode (proteksi katodik).
Teknik perlindungan elektrokimia dengan menghubungkan logam pelindungnya yakni logam yang ldengan nilai E⁰ lebih kecil atau lebih tidak mulia. Logam pelindung ditanam di dalam air atau tanah dekat logam yang ingin dilindungi.
Alhasil akan terbentuk suatu “Sel volta raksasa” yang mana logam pelindung berperan sebagai anode.
Contoh Soal Korosi
Diketahui nilai E⁰ pada dua buah logam:
Ag+ + eˉ → Ag E⁰ = + 0,8 V
Zn²+ + 2 eˉ → Zn E⁰ = -0,76 V
Tentukan manakah yang bertindak sebagai katoda dan anoda …
Jawab:
Elektroda Ag bertindak sebagai katoda. Elektroda Zn bertindak sebagai anoda.
Dampak korosi pada logam atau besi memang tidak bisa dirasakan secara langsung. Hal ini karena proses pengkaratan membutuhkan waktu yang lama. Namun, apabila tidak segera ditanggulangi maka korosi bisa menyebabkan kerusakan sistem atau mesin yang mengancam keselamatan orang banyak.
