Sel volta termasuk ke dalam jenis sel elektrokimia yang dapat menghasilkan arus listrik. Sel elektrokimia sendiri merupakan alat yang digunakan untuk menghasilkan efek kelistrikan dan juga peristiwa kimia. Dalam kehidupan sehari-hari, ada banyak jenis sel volta yang digunakan seperti baterai dan sebagainya.
Pengertian Sel Volta
Sel volta juga dikenal sebagai sel galvani merupakan sel elektrokimia yang bisa menghasilkan arus listrik dari reaksi kimia dengan cara menempatkan elektroda logam ke dalam suatu elektrolit.
Penemuan mengenai sel volta dimulai saat ilmuwan Luigi Galvani (1780) dan Alessandro Volta (1800) melakukan penelitian terbentuknya arus listrik dari reaksi kimia. Saat dilakukan percobaan, ternyata timbul arus listrik yang merupakan reaksi redoks (reduksi oksidasi).
Alat yang digunakan dinamakan sel volta. Energi yang dilepaskan dari reaksi redoks (oksidasi-reduksi) bisa dikonversi menjadi energi listrik yang merupakan cara kerja pada sel volta atau sel galvani. Di dalam sel volta terdapat dua elektrode yakni:
- Elektrode Katode
Elektrode katode merupakan jenis elektrode yang menjadi tempat terjadinya reaksi reduksi, yakni logam Cu. Elektrode katode disebut sebagai elektrode positif di dalam sel volta.
- Elektrode Anode
Elektrode anode merupakan jenis elektrode yang menjadi tempat terjadinya reaksi oksidasi, yakni logam Zn. Elektrode anode disebut sebagai elektrode negatif di dalam sel volta.
Jenis Sel Volta & Manfaatnya dalam Kehidupan Sehari-Hari
Beberapa kegunaan utama sel volta yang banyak ditemukan dalam kehidupan sehari-hari adalah cara kerja aki dan baterai. Baterai termasuk jenis sel volta primer sementara aki termasuk ke dalam jenis sel volta sekunder.
- Sel Baterai
Sel baterai termasuk ke dalam jenis sel volta yang terdiri dari baterai biasa, baterai alkaline, baterai perak oksida, baterai nikad, dan baterai lithium ion.
- Baterai Biasa (Sel Leclanche)
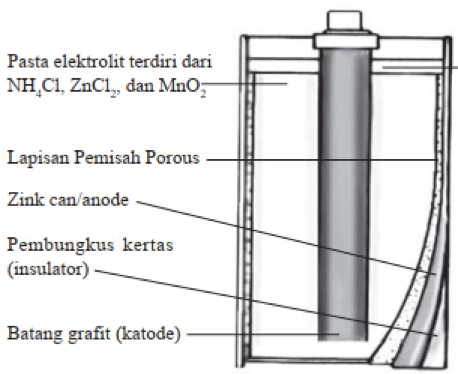
Baterai biasa lebih lumrah dikenal sebagai sel kering dengan jumlah air di dalam baterai sangat sedikit atau dibatasi. Sel pada baterai biasa terdiri dari anode yang merupakan logam seng (Zn) dalam bentuk wadahnya serta katode yang merupakan batang karbon tidak aktif.
Elektrolit yang digunakan pada baterai kering merupakan campuran dari senyawa NH4Cl, MnO2 serta sedikit air yang membentuk pasta. Reaksi yang terjadi pada baterai biasa yakni:
2 MnO2 (s) + 2 NH4+ (aq) + 2 eˉ → Mn2O3 (s) + 2 NH3 (g) +H2O (l)
Amonia (NH3) yang dihasilkan kemudian bereaksi dengan logam seng (Zn²+) akan membentuk senyawa Zn(NH3)4
- Baterai Alkaline
Baterai alkaline adalah jenis sel elektrokimia yang memiliki kelebihan berupa jumlah energi yang dihasilkan 2 kali lebih besar dibandingkan baterai kering atau baterai biasa. Sel baterai alkaline terdiri dari anode berupa logam seng (Zn) yang juga digunakan pada baterai kering sebagai wadah.
Sementara katode sel baterai alkaline terbuat dari oksida mangan (MnO2). Komponen elektrolit pada sel baterai alkaline terbuat dari kalium hidroksida (KOH). Reaksi di dalam baterai alkali adalah:
Zn (s) + MnO2 (s) + 2 H2O (l) → Zn(OH)2 (s) + 2 MnO(OH) (s)
- Baterai Perak Oksida
Baterai perak oksida terbuat dari logam seng (Zn) sebagai anoda sementara katoda dibuat dari material Ag2O. Sementara elektrolit baterai dibuat dari pasta kalium hidroksida (KOH). Baterai berjenis perak oksida mudah ditemukan pada alat elektrolit seperti kalkulator, jam tangan dan lainnya sebagai sumber energi.
Energi yang dihasilkan oleh baterai perak oksida mencapai 1,5 Volt. Reaksi yang terjadi pada baterai perak oksida adalah:
Zn (s) + Ag2O (s) + H2O (l) → Zn(OH)2 (s) + 2 Ag (s)
- Baterai Nikad (Nikel Kadmium)
Baterai nikel cadmium atau baterai nikad termasuk ke dalam jenis baterai kering yang memiliki elektroda-elektroda dari nikel dan cadmium di dalam zat elektrolit alkali. Anoda untuk baterai nikel kadmium adalah kadmium (Cd) sementara katoda adalah nikel atau NiO2.
Energi potensial yang dihasilkan oleh baterai nikel kadmium adalah 1,29 Volt. Kelebihan baterai ini yakni bisa diisi ulang. Reaksi yang terjadi pada baterai nikad yakni:
Cd (s) + NiO2 (s) + 2 H2O (l) → Cd(OH)2 (s) + Ni(OH)2 (s)
- Baterai Lithium Ion
Baterai lithium ion merupakan salah satu jenis baterai ringan yang terdiri dari elektroda-elektroda berupa MnO2 sebagai katoda dan lithium sebagai anoda. Baterai lithium merupakan penemuan terbaru dalam bidang sel volta yang memberikan keuntungan sangat besar bagi peralatan elektronik.
Baterai lithium ion bisa menghasilkan energi lebih besar dalam jangka waktu lama jika dibandingkan jenis baterai standar. Oleh karena itu baterai lithium ion digunakan sebagai baterai pada laptop, baterai pada kamera dan jam dan sebagainya.
- Sel Aki
Sel aki atau akumulator adalah jenis sel volta yang bersifat reversible yakni dapat mengubah kembali hasil reaksi menjadi senyawa awalnya. Oleh karena itu sifat sel aki bisa diisi ulang atau rechargeable battery yang terdiri dari satu maupun beberapa sel penghasil energi listrik dari energi kimia yang ada di dalam sel.
Salah satu jenis sel aki yang paling banyak digunakan adalah akumulator timbal (Pb). Akumulator ini terdiri katoda PbO2 dan anoda berupa logam Pb. Katoda dan anoda disusun secara berselang-seling di dalam bejana yang berisi elektrolit berupa larutan asam sulfat pekat (H2SO4).
Untuk menentukan kapan sel aki harus diisi ulang dengan cara mengukur massa jenis dari larutan elektrolitnya. Massa jenis standar pada sel aki timbal dengan elektrolit dari asam sulfat, maka massa jenis standar elektrolit adalah sekitar 1,25 g/ml sampai dengan 1,30 g/ml.
Apabila massa jenis sudah menurun menjadi 1,20 g/ml atau kurang dari nilai ini maka itu artinya sel aki sudah harus diisi ulang. Untuk mengukur massa jenis sel aki menggunakan alat hidrometer. Jika akumulator sudah diisi kembali maka sel aki sudah bisa digunakan sebagai sumber tegangan.
Contoh Soal Sel Volta
- Jelaskan alasan mengapa sel akumulator disebut sebagai sel sekunder?
Jawab:
Sel akumulator disebut sebagai sel sekunder karena di dalam sel ini reaksi kimianya bisa dibalik atau reversible. Setelah larutan elektrolit diisi kembali di dalam sel akumulaotr, maka akumulator bisa digunakan kembali sebagai sumber tegangan.
- Tentukan apakah bagian anoda dan elektroda dari sel-sel volta di bawah ini:
a. Baterai Kering
b. Baterai Alkali
c. Baterai Perak Oksida
d. Sel Akumulator
Jawab:
a. Baterai Kering: anoda = logam seng (Zn) dan katode = batang karbon tidak aktif.
b. Baterai Alkali: anode = logam seng (Zn) dan katode dari oksida mangan (MnO2)
c. Baterai Perak Oksida: anoda = logam seng (Zn) dan katoda = material Ag2O
d. Sel akumulator: katoda = PbO2 dan anoda = logam Pb.
Penutup
Sel volta termasuk ke dalam sel elektrokimia yang di dalamnya terdiri dari beberapa elektroda logam beserta elektrolit sebagai tempat dimana terjadinya reaksi kimia penghasil arus listrik. Secara umum, sel volta yang banyak dimanfaatkan di kehidupan sehari-hari adalah sel baterai dan sel akumulator.
