Bahan logam adalah bahan pengantar listrik (konduktor) yang paling lazim digunakan. Namun, selain bahan padat, ternyata beberapa zat cair juga bisa menghantarkan listrik. Berdasarkan tingkat daya hantar listriknya, larutan dibedakan kedalam dua jenis yakni larutan elektrolit dan non elektrolit.
Pengertian Larutan
Sebelum membahas mengenai larutan elektrolit dan non elektrolit, harus dipahami pengertian larutan terlebih dahulu. Suatu benda bisa disebut larutan jika terbentuk dari campuran homogen dua zat atau lebih yang masing-masing saling melarutkan sehingga zat penyusunnya tidak bisa dibedakan lagi secara fisik.
Larutan sendiri terdiri dari dua komponen yakni komponen pelarut dan zat terlarut:
- Komponen zat terlarut adalah komponen yang memiliki jumlah lebih sedikit dari pelarutnya
- Komponen pelarut merupakan komponen dengan jumlah lebih banyak atau struktur tidak berubah
Larutan bisa digolongkan menjadi dua jenis berdasarkan wujud pelarut dan daya hantar listriknya. Berdasarkan wujud pelarutnya, larutan dibedakan menjadi larutan cair, larutan padat serta larutan gas. Contoh larutan cair adalah larutan gula, larutan gas seperti udara, dan larutan padat adalah emas 22 karat.
Sementara jenis larutan berdasarkan daya hantar listriknya dibedakan menjadi larutan elektrolit yang bisa menghantarkan arus listrik serta larutan non elektrolit yang tidak bisa menghantarkan arus listrik.
Pengertian Larutan Elektrolit dan Non Elektrolit
Ketika berbicara mengenai larutan, maka salah satu sifat yang penting adalah daya hantar listriknya. Larutan elektrolit dapat menghantarkan listrik dengan anggapan bahwa arus listrik adalah aliran muatan atau aliran elektron.
Contoh larutan elektrolit adalah larutan natrium hidroksida, larutan asam sulfat, larutan asam cuka, larutan garam dapur atau NaCl dan larutan ammonium hidroksida. Sementara larutan non elektrolit adalah larutan yang tidak bisa menghantarkan listrik seperti larutan urea dan larutan gula.
Untuk melihat apakah suatu larutan bersifat elektrolit atau non elektrolit bisa dilakukan dengan menguji nyala lampu melalui larutan tersebut dan keberadaan gelembung gas pada elektroda. Larutan elektrolit kuat ditandai dengan nyala lampu yang menyala terang dan keberadaan gelembung gas pada elektroda.
Sementara larutan elektrolit lemah pada umumnya memiliki nyala lampu yang remang-remang atau bahkan tidak menyala sama sekali. Sementara pada elektroda terdapat gelembung gas yang lebih sedikit. Pada larutan non elektrolit, lampu tidak menyala sama sekali dan pada elektroda tidak terdapat gelembung gas.
Teori Ion Svante Arrhenius
Ada alasan mengapa larutan elektrolit mampu menghantarkan daya listrik sementara larutan non elektrolit tidak bisa. Hal ini sudah dijelaskan oleh seorang ilmuwan bernama Arrhenius di tahun 1887. Arrhenius menjelaskan kemampuan daya hantar listrik larutan elektrolit dan non elektrolit melalui teori ionisasi.
Berdasarkan teori ion Svante Arrhenius, larutan elektrolit dapat menghantarkan arus listrik karena memiliki ion yang bisa bergerak bebas. Ion yang bergerak bebas tersebutlah yang menghantarkan arus listrik melalui medium larutan.
Ion bermuatan positif dinamakan kation sementara ion bermuatan negatif dinamakan anion. Peristiwa terurainya suatu larutan elektrolit menjadi ion-ion dinamakan proses ionisasi.
Misalnya larutan NaCl, HCl, CH3COOH dan NaOH adalah larutan elektrolit yang saat berada dalam air akan terurai menjadi ion berikut ini:
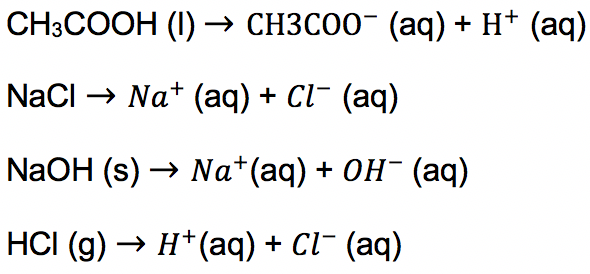
Sementara larutan non elektrolit apabila di dalam larutan tidak terurai menjadi ion, namun tetap dalam bentuk molekul yang tidak bermuatan listrik. Hal ini membuat larutan non elektrolit tidak bisa menghantarkan arus listrik.
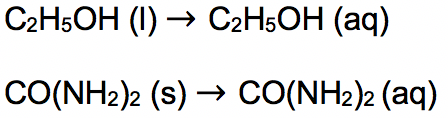
Mengenal Larutan Elektrolit Kuat dan Elektrolit Lemah
Apabila dua buah larutan yang memiliki konsentrasi yang sama dicek daya hantar listriknya, maka kedua larutan tersebut akan memiliki daya hantar listrik berbeda. Pada elektrolit kuat maka daya hantar listriknya lebih baik dibandingkan elektrolit lemah.
Misalnya larutan HCL 1 M dengan larutan CH3COOH 1 M dicek daya hantar listriknya, larutan HCL 1 M akan mempunyai daya hantar lebih baik dibandingkan larutan CH3COOH 1 M.
Perbedaan daya hantar listrik dari kedua larutan tersebut menunjukkan bahwa jumlah ion pada larutan HCL lebih banyak dibandingkan larutan CH3COOH meskipun konsentrasi atau kemolaran sama. Hal ini karena molekul HCl lebih banyak yang mengion dibandingkan molekul CH3COOH.
Sehingga larutan HCl adalah elektrolit lebih kuat dibandingkan CH3COOH.
Derajat Ionisasi (α)
Banyak atau sedikitnya elektrolit yang mengion dituliskan menggunakan derajat ionisasi atau derajat disosiasi (α). Derajat ionisasi adalah perbandingan antara jumlah zat yang mengion terhadap jumlah zat yang dilarutkan.
α = Jumlah zat yang mengion/Jumlah zat awal
Apabila seluruh zat yang dilarutkan mengion maka derajat ionisasi bernilai sama dengan 1. Sementara apabila tidak ada yang mengion maka nilai derajat ionisasi sama dengan 0. Sehingga batas nilai derajat ionisasi (α) adalah
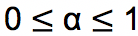
- Elektrolit kuat adalah zat elektrolit dengan nilai derajat ionisasinya besar, yakni mendekati 1. Contoh elektrolit kuat adalah garam dapur (NaCl), larutan asam klorida (HCl), larutan asam sulfat (H2SO4), larutan natrium hidroksida (NaOH).
- Elektrolit lemah adalah zat elektrolit dengan nilai derajat ionisasinya kecil, yakni mendekati 0. Contoh larutan elektrolit lemah yakni larutan asam cuka (CH3COOH) dan juga larutan amonia (NH3).
Pada elektrolit kuat, daya hantarnya relative baik meski konsentrasinya relative kecil. Sementara elektrolit lemah, daya hantarnya relative buruk meski nilai konsentrasinya relative besar.
Senyawa yang Termasuk Larutan Elektrolit Kuat dan Elektrolit Lemah
Apabila tidak dilakukan percobaan melalui nyala lampu dan elektroda, maka tentu cukup sulit untuk membedakan yang manakah larutan elektrolit kuat dan elektrolit lemah. Sebenarnya larutan elektrolit kuat terdiri dari:
- Asam kuat, contoh NaCl, HCl, H2SO4
- Basa kuat, contoh NaOH, Ba(OH)2
- Garam, contoh NaCl, Na2SO4
Sementara larutan elektrolit lemah terdiri dari:
- Asam lemah, contoh CH3COOH, H2SO3, H3PO4
- Basa lemah, contoh NH4OH, Al(OH)3, Fe(OH)2
Contoh Soal Larutan Elektrolit dan Non Elektrolit
1. Tentukan berapakah derajat ionisasi dari larutan asam asetat konsentrasi 0,1 mol yang dilarutkan di dalam 1 liter air, dengan 0,001 mol asam mengion.
Jawab:
α = Jumlah zat yang mengion/Jumlah zat awal
α = 0,001 mol/0,1 mol
α = 0,01
2. Di antara bahan di bawah ini tentukanlah larutan dalam air manakah yang bisa menghantarkan listrik:
a. Garam
b. Cuka
c. Urea
d. Pemutih
e. Gula
Jawab:
Bahan yang dapat menghantarkan listrik dalam bentuk larutan adalah (a) garam, (b) cuka dan (d) pemutih.
Kesimpulan
Larutan elektrolit dan non elektrolit berbicara mengenai kemampuan daya hantar listrik pada larutan. Larutan elektrolit adalah larutan yang bisa menghantarkan listrik sementara larutan non elektrolit tidak bisa menghantarkan daya listrik. Larutan elektrolit dibagi dua yakni elektrolit kuat dan elektrolit lemah.
