Larutan mempunyai beberapa sifat fisis yang khas meliputi bau, warna, titik didih, nilai pH, titik beku dan lainnya. Salah satu sifat fisis penting pada larutan adalah sifat koligatif larutan yang dipengaruhi oleh konsentrasi zat terlarut pada larutan tersebut.
Pengertian Sifat Koligatif Larutan
Ketika air direbus hingga mendidih, maka suhu air yang terukur adalah 100 ⁰C. Jika air tersebut kemudian ditambahkan satu sendok garam, maka suhu air yang mendidih tentu berubah. Perubahan suhu pada air yang mendidih ini termasuk ke dalam sifat fisis larutan yakni sifat koligatif.
Sifat koligatif larutan termasuk ke dalam bagian dari sifat intensif larutan. Seperti yang diketahui bahwa sifat fisis suatu zat dibedakan menjadi dua jenis yakni sifat intensif dan sifat ekstensif. Sifat ekstensif adalah sifat zat yang bergantung kepada ukuran dari zat tersebut misal volume dan massa.
Sementara sifat intensif zat adalah sifat zat yang tidak terpengaruh oleh ukuran sampel zat tersebut, contoh sifat intensif zat adalah massa jenis dan konsentrasi zat tersebut.
Sifat koligatif larutan adalah sifat suatu larutan yang hanya dipengaruhi oleh jumlah partikel dari zat terlarut dalam larutan tersebut yang tidak terpengaruh oleh sifat-sifat dari zat terlarut tersebut.
Beberapa sifat koligatif larutan terdiri dari:
- Penurunan tekanan uap
- Kenaikan titik didih
- Penurunan titik beku
- Tekanan osmosis
Sifat koligatif larutan akan berbeda pada zat terlarut elektrolit dan zat terlarut nonelektrolit meskipun jumlah molnya sama. Pemahaman mengenai sifat koligatif larutan akan membantu dalam menentukan derajat ionisasi, massa molekul relative serta jumlah ion dari zat terlarut.
Penurunan Tekanan Uap (∆P)
Dalam ruang yang tertutup, air yang dipanaskan akan menguap sampai bejana tertutup menjadi jenuh yang disertai oleh pengembunan sehingga terbentuk kesetimbangan air dengan uap air. Uap air yang terbentuk ini akan menimbulkan tekanan yang kemudian menekan ketel.
Saat air sudah mendidih, maka tekanan yang ditimbulkan semakin besar yang menyebabkan tutup pada ketel terangkat. Tekanan yang disebabkan oleh uap jenuh air disebut sebagai tekanan uap jenuh air. Tekanan uap jenuh memiliki besar berbeda-beda antara setiap jenis zat.
Zat yang sulit menguap seperti garam dan glukosa mempunyai uap yang lebih kecil dibandingkan zat yang mudah menguap. Apabila pada air atau pelarut ditambahkan zat terlarut yang sulit menguap maka akan terjadi perubahan pada tekanan uapnya.
a. Jika zat yang dilarutkan sulit menguap maka yang menguap merupakan pelarutnya. Oleh karena itu keberadaan zat terlarut membuat partikel pelarut yang menguap menjadi berkurang. Hal ini menyebabkan penurunan tekanan uap.
b. Penambahan zat terlarut menyebabkan penurunan tekanan uap.
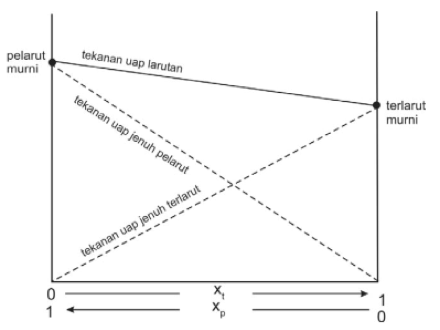
c. Tekanan uap larutan lebih rendah dibandingkan tekanan uap pelarut murni. Penurunan tekanan uap adalah selisih tekanan uap jenuh pelarut murni (P⁰) dengan tekanan uap larutan (P)
∆P = P⁰ – P
Ilmuwan bernama Raoult menjelaskan bahwa tekanan uap larutan berbanding lurus terhadap fraksi mol pelarut dengan tekanan uap pelarut murni.
P = Xp . P⁰, atau
∆P = Xt . P⁰
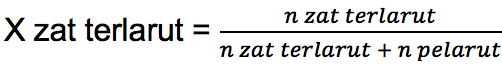
Keterangan:
∆P = Penurunan tekanan uap
Xp = fraksi mol pelarut
Xt = fraksi mol terlarut
P⁰ = Tekanan uap pelarut murni
P = Tekanan uap larutan
n = jumlah mol
Kenaikan Titik Didih (∆Tb)
Titik didih bisa didefinisikan sebagai temperatur saat suatu zat cair mengalami perubahan menjadi gas. Titik didih juga bisa diartikan sebagai temperatur ketika struktur kristal suatu zat padat rusak atau pecah dengan meningkatnya entropi atau derajat ketidakteraturan.
Zat cair bisa disebut mendidih saat jumlah uap yang dihasilkan di atas permukaan zat cair ketika zat cair dipanaskan memungkinkan tekanan pada uap sama dengan tekanan udara di luar.
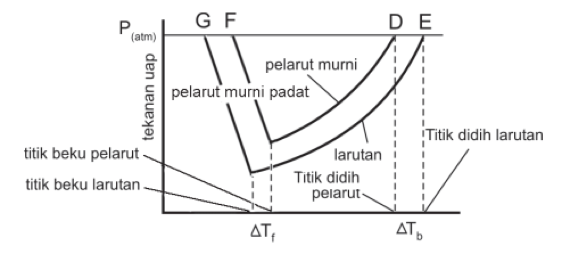
Sehingga bisa disimpulkan bahwa zat cair disebut mendidih jika tekanan uap zat cair atau pelarut pada suatu larutan nilainya sama dengan tekanan udara luar. Maka pada kondisi ini, suhu dikatakan sebagai titik didih.
Titik didih 100 ⁰C adalah titik didih normal air pada tekanan 760 mmHg. Apabila pada zat pelarut atau air tersebut ditambahkan zat terlarut maka dapat menyebabkan penurunan tekanan uap larutan. Hal ini membuat pada suhu 100 ⁰C air belum mendidih.
Artinya, larutan mendidih di titik didih lebih tinggi dibandingkan pelarut murninya.
∆Tb = Tb larutan – Tb pelarut
Penurunan Titik Beku (∆Tf)
Selain pada titik didih, pemberian zat terlarut juga berpengaruh terhadap titik beku larutan. Titik beku larutan nilainya lebih rendah dibandingkan titik beku pelarut murni. Penurunan temperatur beku larutan dirumuskan di bawah ini:
∆Tf = Tf larutan – Tf pelarut
Pada larutan encer, berlaku aturan bahwa penurunan titik beku dan kenaikan titik didih berbanding lurus terhadap konsentrasi molal larutan.
∆Tb = m x Kb
∆Tf = m x Kf
Tekanan Osmotik (π)
Jika ada dua larutan dengan konsentrasi berbeda yang mana salah satu larutan pekat dan yang lain encer kemudian dipisahkan menggunakan membran semipermeabel, maka molekul pelarut mengalir dari larutan lebih encer ke larutan lebih pekat.
Sementara molekul pada zat terlarut tidak mengalir. Molekul pelarut bisa menembus membrane karena ukuran lebih kecil. Aliran zat pelarut dari larutan berkonsentrasi lebih rendah ke larutan yang mempunyai konsentrasi lebih tinggi melalui membran semipermeabel dinamakan osmosis.
Untuk mencegah osmosis, maka harus diberi tekanan pada permukaan larutannya. Tekanan yang diberikan ini disebut tekanan osmotik.
π = CRT
Contoh Soal Sifat Koligatif Larutan
Di dalam 1 kg air dilarutkan ke dalamnya sukrosa C12H22O11 sebanyak 1026 gram. Tentukan beberapa hal di bawah ini: (Diketahui Ar H = 1, C = 12, O = 16)
a. Tekanan uap larutan
b. Penurunan tekanan uap (∆P) jika tekanan uap jenuh air sebesar 31,82 mmHg
Jawab:
Mr sukrosa = (12 x 12) + (1 x 22) + (16 x 11) = 342 g/mol
mol zat terlarut = massa : Mr sukrosa
mol zat terlarut = 1026 gram : 342 g/mol = 3 mol
Mr H2O = (1 x 2) + (16) = 18 g/mol
mol pelarut = massa : Mr air
mol pelarut = 1000 gram : 18 g/mol = 55,6 mol

a. P = Xp . P⁰
P = 0,95 x 31,82 mmHg
P = 30,229 mmHg
b. ∆P = P⁰ – P
∆P = 31,82 mmHg – 30,229 mmHg
∆P = 1,591 mmHg
Pemberian zat terlarut nonelektrolit yang tidak mudah menguap pada zat pelarut akan menyebabkan tekanan uap turun, titik didih naik dan titik beku menurun. Sifat koligatif larutan adalah sifat intensif zat yang khusus berlaku pada larutan saja.
