Proses elektrolisis merupakan kebalikan dari reaksi redoks spontan pada sel volta yang mengubah energi kimia menjadi energi listrik. Pada elektrolisis, proses yang terjadi secara sederhana bisa digambarkan sebagai suatu proses untuk menghasilkan energi kimia menggunakan energi listrik.
Pengertian Elektrolisis
Elektrolisis yakni suatu peristiwa penguraian senyawa elektrolit dikarenakan adanya arus listrik yang dialirkan searah. Proses elektrolisis adalah proses menghasilkan energi kimia menggunakan energi listrik.
Sehingga elektrolisis juga bisa diartikan sebagai proses pengaliran listrik melalui zat yang terlarut atau meleleh agar menginduksi penguraian zat yang terlarut atau meleleh tersebut menjadi komponen-komponennya.
Alat yang digunakan dalam proses elektrolisis disebut sel elektrolisis. Energi kimia dapat dihasilkan oleh energi listrik di dalam sel elektrolisis.
Sel elektrolisis sendiri diibaratkan seperti pompa yang menjalankan perpindahan elektron yang mengalir melalui anode menuju katode. Elektron berpindah melalui elektrode inert atau elektrode tidak bereaksi. Elektrode inert yang digunakan umumnya batang platina atau batang karbon.
Pada proses elektrolisis, oksidasi atau proses pelepasan elektron terjadi di batang anode sementara peristiwa reduksi terjadi di katode. Agar proses elektrolisis bisa berlangsung, maka kutub positif dari sumber arus luar dihubungkan ke elektroda positif yakni pelat anoda.
Sementara kutub negatif dihubungkan ke elektroda negatif yakni katoda.
Elektroda yang Digunakan Pada Sel Elektrolisis
Berbagai elektroda juga digunakan pada sel elektrolisis sebagaimana pada sel volta. Secara umum, elektroda pada sel elektrolisis dibagi menjadi 2 jenis yakni elektroda inert dan elektroda aktif.
- Elektroda Inert
Elektroda inert adalah jenis elektroda tidak aktif yang tidak bereaksi dengan larutan elektrolitnya seperti atom platina (Pt) dan atom karbon (C).
- Elektroda Aktif
Elektroda aktif adalah jenis elektroda yang bisa bereaksi dengan elektrolitnya. Jenis elektroda aktif adalah semua elektroda selain atom platina (Pt) dan atom karbon (C). Termasuk ke dalam jenis elektroda aktif adalah perak (Ag), tembaga (Cu), besi (Fe) dan nikel (Ni).
Elektroda pada umumnya dalam bentuk logam sehingga elektrode mempengaruhi reaksi oksidasi di anode. Elektrode yang bereaksi hanya ada di anode. Sementara di katode, elektrode tidak bereaksi.
Reaksi Pada Sel Elektrolisis
- Reaksi yang terjadi di katode
Jenis kation yang ada di larutan elektrolit (pelarut air) mempengaruhi reaksi pada katode.
a. Apabila kation ion Na+, K+, Mg²+, Ca²+, Be²+, Mn²+, dan Al³+ maka reaksi yang terjadi di katode adalah:
2 H2O (l) + 2 eˉ → 2 OHˉ (aq) + H2 (g)
b. Apabila kation H+ berasal dari zat asam, maka reaksi yang terjadi pada katode adalah:
2 H+ (aq) + 2 eˉ → H2 (g)
c. Apabila kation selain a dan b maka terjadi reaksi reduksi yang diendapkan pada katode seperti di bawah ini:
Ag+ (s) + eˉ → Ag (s)
Cu²+ (s) + 2 eˉ → Cu (s)
- Reaksi yang terjadi di anode
Apabila anode terbuat dari zat inert seperti C, Au dan Pt maka reaksi yang terjadi adalah:
a. Apabila anion yang bergerak menuju anode yakni OHˉ dari senyawa basa maka OHˉ akan teroksidasi dengan reaksi berikut:
4 OHˉ (aq) → 2 H2O (l) + O2 (g) + 4 eˉ
b. Apabila anionnya Clˉ, Iˉ dan Brˉ sehingga ion akan teroksidasi seperti di bawah ini:
2 Clˉ (aq) → Cl2 (s) + 2 eˉ
2 Brlˉ (aq) → Br2 (g) + 2 eˉ
c. Apabila anion dari sisa asam oksi seperti NO3ˉ dan SO4²ˉ sehingga anode tidak teroksidasi sementara yang teroksidasi adalah H2O. Reaksi yang terjadi adalah:
2 H2O → 4 H+ + O2 + 4 eˉ
Manfaat Elektrolisis dalam Kehidupan Sehari-Hari
Konsep elektrolisis banyak diterapkan di berbagai bidang terutama bidang industri seperti pemurnian logam, produksi beberapa bahan kimia hingga penyepuhan logam.
- Pemurnian Logam
Proses elektrolisis sangat penting dalam proses pemurnian logam seperti tembaga. Tembaga murni sangat dibutuhkan dalam pembuatan kabel listrik agar dapat mengalirkan arus listrik lebih optimal. Namun, pengolahan tembaga dari bijih kalkopirit akan menghasilkan tembaga dengan sejumlah pengotor.
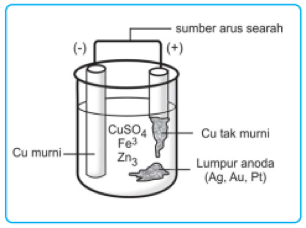
Tembaga yang didapatkan bercampur dengan sedikit platina, emas dan perak. Oleh karena itu tembaga tidak murni ini kemudian dimurnikan dengan proses elektrolisis. Caranya dengan memasang tembaga tidak murni sebagai anoda sementara tembaga murni dijadikan sebagai katoda.
Kedua elektroda dimasukkan ke dalam cairan elektrolit CuSO4. Selanjutnya tembaga di anoda akan teroksidasi menjadi Cu²+ dan kemudian direduksi di katoda. Tembaga pada anoda kemudian pindah ke katoda sehingga anode akan semakin habis sementara katoda membesar.
Pemurnian tembaga menghasilkan hasil samping berupa lumpur anoda yang terbentuk memiliki kandungan platina, emas dan perak.
- Produksi Beberapa Senyawa Kimia
Beberapa senyawa kimia seperti logam alkali hingga alkali tanah aluminium, gas klorin, gas hidrogen, natrium hidroksida dan gas oksigen dibuat melalui proses elektrolisis. Logam natrium misalnya dibuat melalui proses elektrolisis lelehan NaCl yang kemudian dicampurkan dengan CaCl2.
Proses pembuatan logam natrium seperti di bawah ini:
2 Na+ (l) + 2 Clˉ (l) → 2 Na (l) +Cl2 (g)
Natrium cair sebagai hasil elektrolisis terbentuk di katoda akan mengapung di atas cairan NaCl untuk selanjutnya dikumpulkan pada kolektro.
- Penyepuhan Logam
Proses elektrolisis adalah salah satu cara yang banyak digunakan untuk melapisi dan menyepuh logam agar terlindungi dari proses korosi atau perkaratan. Proses penyepuhan dilakukan dengan cara melapisi suatu logam dengan lapisan tipis dari logam lainnya yang memiliki sifat tahan korosi dan mengkilap.
Pada proses elektrolisis penyepuhan logam, logam yang ingin dilapisi dijadikan sebagai katoda sementara potongan logam penyepuhnya dijadikan sebagai anoda yang kemudian dibenamkan di dalam larutan garam dari logam penyepuh. Antara katoda dan anoda dihubungkan menggunakan sumber arus searah.
Contoh gambar di bawah ini menunjukkan proses penyepuhan sendok dengan logam perak. Sendok dibuat dari bahan baja yang dijadikan sebagai katoda. Logam perak dipasang sebagai anoda. Elektrolit yang digunakan adalah larutan AgNO3.
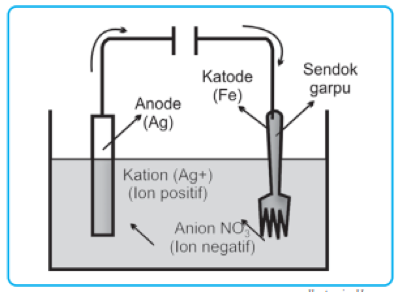
Pada gambar di atas terlihat bahwa logam perak di anoda teroksidasi menjadi Ag+ dan selanjutnya direduksi menjadi logam Ag pada katoda.
Contoh Soal Elektrolisis
Tuliskan elektrolisis yang terjadi pada anode dan katode pada larutan H2SO4 (aq)
Jawab:
Elektrolisis: 2 H2SO4 (aq) + 2 H2O (l) → 2 H2 (g) + 2 SO4²ˉ (aq) + 4 H+ (aq) + O2 (g)
Elektrolisis merupakan peristiwa terurainya zat elektrolit menggunakan arus listrik searah. Energi listrik di dalam sel elektrolisis dapat menghasilkan reaksi kimia. Proses elektrolisis erat kaitannya dengan pemahaman mengenai reaksi oksidasi dan reduksi yang sudah dipelajari sebelumnya.
