Laju reaksi adalah seberapa cepat atau seberapa lambat berkurangnya pereaksi atau terbentuknya suatu produk. Seiring dengan waktu reaksi bertambah, maka jumlah produk yang dihasilkan semakin banyak sementara jumlah zat pereaksinya akan berkurang.
Persamaan Laju Reaksi
Untuk mengetahui bagaimanakah pengaruh konsentrasi terhadap laju reaksi secara kuantitatif atau terukur, maka dibutuhkan suatu persamaan. Persamaan laju reaksi adalah persamaan yang digunakan untuk menunjukkan hubungan kuantitatif antara konsentrasi pereaksi dengan laju reaksi.
Bentuk persamaan laju reaksi dituliskan seperti di bawah ini:
h A + i B → j C + l D
Sehingga persamaan laju reaksinya dituliskan menjadi:
v = k [A]˟ [B]ʸ
Keterangan:
k = tetapan jenis reaksi
x = orde atau tingkat (pangkat) reaksi terhadap pereaksi A
y = orde atau tingkat (pangkat) reaksi terhadap pereaksi B
Nilai k yang merupakan tetapan jenis reaksi merupakan tetapan yang nilainya tetap namun bergantung kepada jenis katalis, suhu dan pereaksi. Oleh karena itu setiap reaksi mempunyai harga k tertentu di suhu tertentu.
Apabila reaksi yang berlangsung cepat, maka artinya nilai k pun besar begitu pula sebaliknya. Pemakaian katalis dan kenaikan suhu akan memperbesar tetapan jenis reaksi.
Orde Reaksi
Orde reaksi merupakan pangkat konsentrasi pereaksi pada persamaan laju reaksi. Pada persamaan laju reaksi yang sudah dijelaskan di atas, maka orde reaksinya adalah x terhadap A dan y terhadap B. Sehingga total orde reaksi adalah x + y.
Saat berbicara laju reaksi, maka yang dimaksud orde reaksi adalah orde reaksi keseluruhan. Orde reaksi umumnya berupa bilangan bulat positif sederhana seperti 1 atau 2, namun terkadang juga ada orde reaksi bernilai 0, ½, maupun orde reaksi negatif.
Orde reaksi sendiri menunjukkan besarnya pengaruh konsentrasi pereaksi pada laju reaksi.
- Reaksi Orde Nol
Reaksi disebut orde nol terhadap salah satu pereaksinya jika perubahan konsentrasi pereaksi tidak berpengaruh terhadap laju reaksi. Maknanya, selama terdapat dalam jumlah tertentu perubahan konsentrasi pereaksi tidak berpengaruh terhadap laju reaksi.
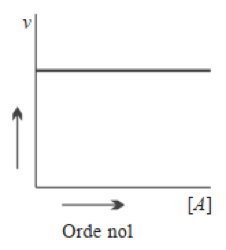
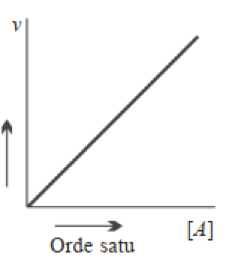
- Reaksi Orde Satu
Reaksi kimia disebut memiliki orde satu jika besar laju reaksi berbanding lurus terhadap besarnya konsentrasi pereaksi. Maknanya, apabila konsentrasi pereaksi dinaikkan sebanyak tiga kali awalnya, laju reaksi juga akan meningkat sebanyak (3)¹ atau 3 kali semula. Misal reaksi orde satu:
2 N2O5 (g) → 4 NO2 (g) + O2 (g) v = k [N2O5]
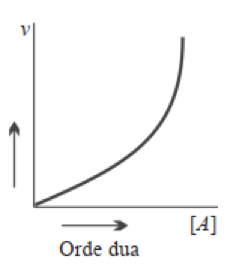
- Reaksi Orde Dua
Reaksi orde dua adalah reaksi yang laju reaksinya adalah pangkat dua dari meningkatnya konsentrasi pereaksinya. Maknanya apabila konsentrasi pereaksi ditingkatkan sebanyak 3 kali semula, maka laju reaksinya akan meningkat sebanyak (3)² atau 9 kali laju reaksi mula-mula. Contoh reaksi orde dua:
2 HI (g) → H2 (g) + I2 (g) v = k [HI]²
- Reaksi Orde Negatif
Reaksi kimia berorde negatif jika besar laju reaksi berbanding terbalik terhadap konsentrasi pereaksinya. Maknanya jika konsentrasi pereaksinya meningkat maka laju reaksi justru menurun.
Faktor-Faktor yang Mempengaruhi Laju Reaksi
- Konsentrasi Pereaksi
Konsentrasi pada pereaksi memiliki pengaruh terhadap laju reaksi yakni reaksi akan berlangsung lebih cepat ketika konsentrasi zat-zat pereaksinya diperbesar.
Konsentrasi zat yang lebih besar memiliki jumlah partikel yang lebih banyak sehingga partikel akan tersusun lebih rapat dibandingkan partikel berkonsentrasi rendah. Susunan partikel yang lebih rapat akan membuat tumbukan antar partikel lebih sering terjadi sehingga probabilitas terjadinya reaksi lebih besar.
- Luas Permukaan
Faktor luas permukaan zat-zat yang bereaksi juga turut mempengaruhi laju reaksi. Sebelum membahas sejauh mana pengaruh luas permukaan zat padat terhadap laju reaksi, hal yang perlu dipahami adalah hubungan luas permukaan zat padat dengan ukuran partikelnya.
Luas permukaan zat padat yang memiliki ukuran partikel besar tentu lebih kecil dibandingkan luas permukaan zat padat dengan ukuran partikel kecil. Sebagai contoh bangun kubus yang memiliki panjang sisi 1 cm akan mempunyai luas permukaan 6 cm².
Jika kubus tersebut dibagi menjadi 8 bagian berbentuk kubus yang sama dan sebangun, maka panjang sisi setiap kubus adalah 0,5 cm. Jika dihitung, total luas permukaan bangun kubus yang baru adalah 12 cm². Sehingga bisa disimpulkan bahwa luas permukaan kubus menjadi bertambah.
Kesimpulannya adalah semakin kecil ukuran partikel zat padat maka total luas permukaan membesar. Semakin besar luas permukaan zat padat yang bereaksi atau semakin halus kepingan zat padat, maka semakin cepat pula reaksi terjadi.
Sementara semakin kecil luas permukaan zat padat yang bereaksi atau semakin kasar kepingan zat padatnya, maka reaksi yang terjadi lebih lambat. Kepingan yang halus dapat bereaksi lebih cepat karena luas bidang sentuh semakin besar.
- Temperatur
Laju reaksi dapat diperlambat maupun dipercepat apabila suhunya diubah. Pada kehidupan sehari-hari, bisa dilihat bahwa pada suhu yang lebih tinggi maka reaksi akan berlangsung lebih cepat. Mengapa temperatur yang lebih tinggi memungkinkan reaksi berlangsung lebih cepat?
Hal ini dikarenakan suhu yang dinaikkan akan membuat energi kinetik atau energi gerak partikel bertambah. Energi gerak partikel yang bertambah akan membuat tumbukan antar partikel lebih sering terjadi.
Frekuensi tumbukan yang lebih besar akan membuat probabilitas terjadinya tumbukan efektif meningkat. Tumbukan efektif adalah tumbukan yang bisa menghasilkan reaksi. Selain meningkatkan energi kinetik, suhu juga meningkatkan energi potensial zat.
Energi potensial berpengaruh terhadap probabilitas terjadinya tumbukan efektif. Partikel dengan energi potensial rendah akan sulit menghasilkan tumbukan efektif karena partikelnya tidak mampu melebihi energi aktivasi.
- Katalis
Katalis merupakan zat yang bisa mempercepat laju reaksi namun zatnya tidak mengalami perubahan yang bersifat kekal yakni tidak dihabiskan atau tidak dikonsumsi. Contoh senyawa katalis adalah larutan besi (III) klorida atau FeCl3 terhadap reaksi peruraian larutan hidrogen peroksida (H2O2).
Senyawa besi (III) klorida akan mempercepat reaksi peruraian larutan hidrogen peroksida di suhu kamar. Zat katalis ini juga tidak dikonsumsi oleh reaksi sehingga tidak mengubah kondisi senyawa-senyawa pada saat reaksi berlangsung.
- Tekanan
Pengaruh tekanan terhadap laju reaksi terjadi pada reaksi yang melibatkan pereaksi berwujud gas. Penambahan tekanan pada pereaksi berwujud gas dilakukan dengan mengurangi volume wadah tampungan gas.
Volume yang mengecil akan membuat konsentrasi membesar sehingga partikel-partikel gas semakin sering bertumbukan. Hal ini akan memperbesar laju reaksi. Contoh industri yang melibatkan pereaksi gas seperti pembuatan amonia dilakukan pada kondisi tekanan tinggi.
Contoh Soal Laju Reaksi
Tentukan berapakah besar laju reaksi pada persamaan laju reaksi v = 1,2 x 10⁴ [NO]² [Br2] jika konsentrasi [NO] = 0,1 dan [Br2] = 0,1.
Jawab:
v = 1,2 x 10⁴ [NO]² [Br2]
v = 1,2 x 10⁴ (0,1)² (0,1)
v = 12 M/detik
