Ikatan kimia merupakan ikatan yang menggabungkan berbagai unsur-unsur pembentuk senyawa sehingga terbentuk senyawa baru yang memiliki sifat berbeda dari unsur penyusunnya. Berbagai senyawa yang ada di alam semesta ditemukan dalam bentuk persenyawaan berbagai unsur yang saling terikat.
Kestabilan Unsur-Unsur
Unsur yang ada pada tabel periodik unsur pada umumnya berada dalam kondisi tidak stabil apabila dalam bentuk monoatomik. Oleh karena berada dalam kondisi tidak stabil, maka atom-atom tersebut secara alami akan berusaha untuk mencapai kestabilan.
Untuk mencapai kestabilan maka atom-atom unsur tersebut akan berikatan dengan sesamanya ataupun atom unsur berbeda. Hanya golongan VIIIA saja yang atom unsurnya berada dalam kondisi stabil dan tidak reaktif.
Ikatan kimia bekerja berdasarkan dua aturan yakni aturan duplet dan aturan octet. Aturan octet dirumuskan oleh Kossel Lewis yang meneliti konfigurasi elektron pada kulit terluar dari unsur gas-gas mulia. Sementara aturan duplet dirumuskan dengan mengamati atom He yang hanya memiliki 2 elektron di kulit terluar.
- Aturan duplet yakni aturan konfigurasi elektron stabil yang mempunyai 2 buah elektron di kulit terluarnya. Contohnya atom hidrogen menggunakan aturan duplet yakni membentuk konfigurasi 2 elektron di kulit terluar.
- Aturan octet yakni konfigurasi elektron stabil yang mempunyai 8 buah elektron di kulit paling luar atom.
Ketika beberapa atom saling membentuk ikatan kimia, maka elektron di kulit paling luar dari atom tersebut atau elektron valensi yang memainkan peran penting. Untuk memudahkan, elektron valensi biasa digambar berupa titik-titik elektron di sekeliling lambang atom. Misalnya atom Nitrogen memiliki elektron valensi 5.

Pemahaman mengenai struktur Lewis sangat penting sebagai dasar dalam memahami berbagai ikatan-ikatan kimia lainnya seperti penggunaan elektron bersama pada ikatan kovalen.
Ikatan Ion dan Ikatan Kovalen
Ikatan kimia yang terbentuk antara berbagai unsur bisa membentuk senyawa dari unsur yang sama seperti unsur-unsur berbentuk gas seperti gas Oksigen (O2), gas Nitrogen (N2). dan gas Hidrogen (H2). Unsur-unsur pada tabel periodik juga bisa bergabung dengan unsur lainnya seperti CH4, NaCl, HCl, dan NO2.
Ikatan kimia yang terbentuk saat proses penggabungan unsur-unsur tabel periodik dipengaruhi oleh proses atau cara agar unsur bisa mendapatkan konfigurasi elektron yang stabil baik dengan cara menarik atau melepaskan elektron maupun penggunaan bersama antara elektron-elektron valensi.
Jenis ikatan kimia yang terbentuk bisa berupa ikatan ion dan ikatan kovalen.
- Ikatan Ion
Ikatan ion adalah salah satu ikatan kimia yang terbentuk karena adanya perpindahan elektron dari satu atom ke atom yang lainnya. Ikatan ion berupa gaya tarik-menarik listrik antara beberapa ion yang memiliki muatan berbeda. Ikatan ion juga dikenal sebagai ikatan elektrovalen.
Ikatan ion hanya dapat terbentuk dari unsur-unsur yang apabila direaksikan memiliki perbedaan daya tarik elektron atau keelektronegatifan besar. Oleh karena ada daya tarik elektron yang besar membuat terjadinya serah terima elektron.
Umumnya ikatan ion terjadi antara unsur-unsur logam seperti golongan IIIA dan IIA dengan unsur-unsur non logam seperti golongan VIA dan VIIA. Unsur logam memiliki daya tarik elektron yang lemah sehingga relative mudah untuk melepas elektron.
Sementara unsur non logam memiliki daya tarik elektron atau keelektronegatifan yang besar sehingga mudah menarik elektron dari atom lainnya.
Sifat-Sifat Senyawa Ion
Apabila ikatan yang terbentuk di dalam senyawa atau molekul adalah ikatan ion, maka jenis senyawa yang terbentuk adalah senyawa ion. Senyawa ion mempunyai beberapa sifat khusus yang membedakannya dari jenis senyawa lainnya:
- Senyawa ion berbentuk zat padat yang memiliki titik didih dan titik leleh yang relative tinggi. Contoh senyawa ion adalah garam dapur NaCl yang baru meleleh pada suhu 801 ⁰C
- Lelehan dari senyawa ion dapat menghantarkan listrik
- Sifat senyawa ion rapuh dan mudah hancur apabila terkena benturan benda keras
- Larutan senyawa ion di dalam air bisa menghantarkan listrik
- Ikatan Kovalen
Ikatan kovalen berbeda dari ikatan ion yang melibatkan sesama atom-atom non logam. Karena ikatan yang terbentuk di antara atom-atom non logam maka tidak mungkin terjadi proses serah terima elektron karena besar keelektronegatifannya hampir sama atau bahkan nilainya sama.
Oleh karena itu ikatan kovalen terbentuk dari penggunaan bersama pasangan elektron dari unsur-unsur senyawa. Pasangan elektron terbentuk menjadi milik bersama, yakni ditarik oleh kedua inti atom yang berikatan.
Apabila ikatan yang terbentuk di dalam senyawa atau molekul adalah ikatan kovalen, maka jenis senyawa yang terbentuk adalah senyawa kovalen. Senyawa kovalen memiliki sifat fisis berbentuk gas, cairan serta padatan lunak di suhu ruang.
Hal ini dikarenakan gaya antar molekul pada senyawa kovalen relative lemah sehingga bisa bergerak lebih bebas. Titik leleh dan titik didih senyawa kovalen juga sangat rendah. Senyawa kovalen biasanya tidak larut di dalam air namun bisa larut di dalam pelarut organik.
Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi merupakan ikatan kovalen yang terbentuk dengan pasangan elektron yang digunakan bersama-sama hanya berasal dari satu atom sementara atom yang lainnya tidak menyumbangkan elektron sama sekali.
Syarat terjadinya ikatan kovalen koordinasi adalah salah satu atom memiliki pasangan elektron bebas (PEB).
- Ikatan Logam
Ikatan yang terbentuk antara material-material logam adalah ikatan logam. Ikatan logam akan membentuk senyawa logam yang memiliki sifat fisis berbentuk padatan di suhu ruang, bersifat keras namun tidak mudah patah apabila ditempa, senyawa logam mudah menghantarkan listrik.
Elektron valensi pada logam memiliki derajat kebebasan yang cukup sehingga elektron valensinya tidak selalu dipakai oleh ion yang sama. Saat unsur mendapat energi, elektronnya akan dioperkan dari satu atom ke atom lainnya.
Contoh Soal Ikatan Kimia
Buatlah struktur Lewis dari beberapa molekul senyawa di bawah ini:
a. SiF4
b. HCl
c. H2O
d. NH3
Jawab:
a. SiF4
Atom Si memiliki elektron valensi 4 dan atom F memiliki elektron valensi 7. Sehingga struktur Lewis dari molekul SiF4 seperti di bawah ini:
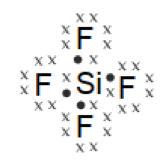
b. HCl
Atom Cl memiliki elektron valensi 7 dan atom H memiliki elektron valensi 1. Sehingga struktur Lewis dari molekul HCl seperti di bawah ini:
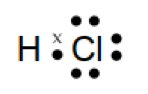
c. H2O
Atom O memiliki elektron valensi 6 dan atom H memiliki elektron valensi 1. Sehingga struktur Lewis dari molekul H2O seperti di bawah ini:
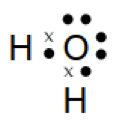
d. NH3
Atom N memiliki elektron valensi 5 dan atom H memiliki elektron valensi 1. Sehingga struktur Lewis dari molekul NH3 seperti di bawah ini:
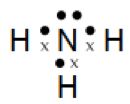
Kesimpulan
Ikatan kimia adalah ikatan yang terbentuk dengan menggabungkan berbagai unsur-unsur pembentuk senyawa sehingga terbentuk senyawa baru yang memiliki sifat berbeda dari unsur penyusunnya. Contoh ikatan kimia yang terjadi antara atom-atom adalah ikatan ion, ikatan kovalen dan ikatan logam.
