Posisi elektron pada atom terus menjadi perbincangan hangat di kalangan para ilmuwan. Untuk menentukan susunan atom pada kulit atom, maka digunakanlah model atom Bohr dan juga model atom mekanika kuantum. Keduanya memiliki sedikit perbedaan dalam hal konfigurasi elektron.
Pengertian Konfigurasi Elektron
Elektron bergerak di sekeliling inti atom pada masing-masing orbitnya yang disebut kulit elektron. Jumlah kulit elektron atom pada tabel periodik unsur sesuai dengan nomor periode dari unsur atom tersebut. Sementara nomor atomnya sama dengan jumlah elektron atom tersebut.
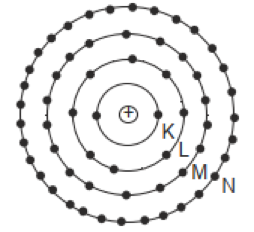
Kulit elektron dituliskan dengan lambang K, L, M, N, O dan seterusnya. Persebaran elektron dalam kulit-kulit atom merupakan pengertian dari konfigurasi elektron.
Aturan Penulisan Konfigurasi Elektron
Berdasarkan teori atom Niels Bohr, elektron pada atom akan menempati kulit-kulit atom. Kulit K adalah kulit yang paling dekat dengan inti atom biasa ditempati oleh 2 elektron. Sementara pada kulit kedua yakni kulit L akan ditempati oleh 8 elektron, terus berikutnya hingga kulit paling luar dari atom.
Semakin besar nomor kulitnya maka semakin banyak juga jumlah elektron yang bisa menempati kulit atom tersebut. Hal ini dikarenakan semakin besar nomor kulit maka semakin besar ruang cakupannya. Jumlah maksimum elektron di setiap kulit akan memenuhi rumus 2n²(n merupakan nomor kulit).
- Kulit K (kulit atom n = 1) maksimal elektron 2 x 1² = 2 elektron
- Kulit L (kulit atom n = 2) maksimal elektron 2 x 2² = 8 elektron
- Kulit M (kulit atom n = 3) maksimal elektron 2 x 3² = 18 elektron
- Kulit N (kulit atom n = 4) maksimal elektron 2 x 4² = 32 elektron
- Kulit O (kulit atom n = 5) maksimal elektron 2 x 5² = 50 elektron
Perlu dipahami bahwa pada kulit O, P dan kulit Q meskipun bisa menampung lebih dari 32 elektron, namun pada kulit-kulit ini belum pernah terisi sampai penuh. Elektron pertama dan juga elektron kedua akan menempati kulit pertama atau kulit K.
Sehingga konfigurasi elektron dari atom hidrogen dengan nomor atom = 1 serta atom helium dengan nomor atom = 2 ditulis dengan konfigurasi berikut ini:
1H : K = 1
2He : K = 2
Kulit K hanya bisa ditempati oleh maksimal 2 buah elektron saja. Sementara elektron ketiga akan mengisi kulit berikutnya yakni kulit L. Kulit L bisa ditempati oleh maksimal 8 elektron sehingga unsur yang mempunyai nomor atom 3 sampai 10 akan mengisi hingga penuh kulit L.
Catatan mengenai cara menuliskan konfigurasi elektron unsur-unsur golongan utama harus memperhatikan hal-hal di bawah ini:
- Pertama-tama isi penuh sebanyak mungkin elektron pada kulit atom sampai jumlah maksimal terpenuhi, selanjutnya hitung sisa elektronnya
- Apabila sisa elektron kurang dari 32, maka pada kulit berikutnya diisi dengan 18 elektron
- Apabila sisa elektron kurang dari 18, maka kulit selanjutnya diisi dengan 8 elektron
- Apabila sisa elektron kurang dari 8 elektron, maka tempatkan elektron di kulit berikutnya sebagai kulit paling luar
Konfigurasi Elektron Gas Mulia
Unsur gas mulia jika dibandingkan dengan rumus lainnya adalah unsur yang paling stabil. Kestabilan unsur gas mulia dikarenakan susunan elektron gas mulia berjumlah 8 di kulit paling luar, kecuali atom helium (memiliki konfigurasi elektron penuh).
Aturan mengenai konfigurasi elektron gas mulia dengan 8 elektron di kulit terluar disebut konfigurasi octet sementara atom helium memiliki konfigurasi duplet.
| Periode | Unsur | Nomor Atom | Kulit K | Kulit L | Kulit M | Kulit N | Kulit O | Kulit P |
| 1 | He | 2 | 2 | |||||
| 2 | Ne | 10 | 2 | 8 | ||||
| 3 | Ar | 18 | 2 | 8 | 8 | |||
| 4 | Kr | 36 | 2 | 8 | 18 | 8 | ||
| 5 | Xe | 54 | 2 | 8 | 18 | 18 | 8 | |
| 6 | Rn | 86 | 2 | 8 | 18 | 32 | 18 | 8 |
Unsur yang lain selain unsur-unsur gas mulia bisa mencapai konfigurasi octet dengan cara membentuk ikatan dengan unsur lainnya atau atom sejenis untuk menyamakan konfigurasi elektronnya dengan konfigurasi elektron gas mulia paling dekat.
Kecenderungan untuk mencapai konfigurasi gas mulia terdekat disebut aturan octet. Konfigurasi octet yang merupakan konfigurasi stabil gas mulia bisa dicapai baik dengan menangkap elektron, melepas elektron hingga memasangkan elektron.
Bilangan-Bilangan Kuantum
Sebagaimana model atom Bohr, model atom mekanika kuantum juga menggunakan tingkat-tingkat energi (kulit) dalam atom. Namun, pada model atom mekanika kuantum ditambahkan detail satu hingga beberapa subkulit pada setiap kulit-kulit atomnya. Setiap subkulit terdiri dari satu hingga beberapa orbital.
Pada teori atom mekanika kuantum, terdapat 3 bilangan untuk menunjukkan orbital yakni bilangan kuantum utama (n), bilangan kuantum azimuth (l) dan bilangan kuantum magnetic (m).
- Bilangan Kuantum Utama (n)
Bilangan kuantum utama (n) menentukan kulit atom atau tingkat energi orbital. Bilangan kuantum utama dituliskan dengan bilangan bulat positif 1, 2, 3, 4 dan seterusnya. Sebagai contoh, bilangan kuantum utama n = 2 berada pada kulit kedua yakni kulit L.
- Bilangan Kuantum Azimut (l)
Subkulit dituliskan dengan bilangan kuantum azimuth dalam bentuk bilangan bulat mulai dari 0 hingga (n – 1) untuk setiap nilai n.
- Untuk n = 1, maka nilai l = 0 artinya kulit K memiliki 1 subkulit
- Untuk n = 2, maka nilai l = 0 dan 1 artinya kulit L memiliki 2 subkulit
Bilangan kuantum azimuth menyatakan bentuk orbital yang dinyatakan dengan huruf s, p, d, f, g dan seterusnya.
- Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik menunjukkan orientasi orbital pada ruang. Nilai bilangan kuantum magnetik adalah bilangan bulat mulai dari –l, 0 sampai +l. Misal untuk l = 2 maka nilai m = -2, – 1, 0, +1 dan +2.
Contoh Soal Konfigurasi Elektron
Tuliskan konfigurasi elektron atom Cesium (Cs) dengan nomor atom 55
Jawab:
Pertama-tama elektron diisi ke kulit atom K, L dan M:
Kulit K = 2
Kulit L = 8
Kulit M = 18
Total elektron yang sudah ditempatkan di kulit atom = 28
Sisa elektron yang belum ditempatkan di kulit = 55 – 28 = 27
Sesuai aturan pengisian kulit atom di atas, karena sisa elektron kurang dari 32 maka kulit selanjutnya (kulit N) terisi 18 elektron.
Sisa elektron = 27 – 18 = 9 elektron.
Kulit selanjutnya (kulit O) terisi oleh 8 elektron. Sisa 1 elektron terakhir mengisi kulit P yang menjadi kulit paling luar. Konfigurasi lengkap atom:
55Cs : 2 8 18 18 8 1
Penutup
Konfigurasi elektron merupakan susunan elektron di masing-masing kulit atom. Konfigurasi elektron sederhana mengikuti model atom Bohr. Namun, untuk mendapat gambaran konfigurasi elektron lebih detail maka digunakanlah model atom mekanika kuantum.
