Ketika reaksi berjalan di sistem tertutup seringkali didapatkan zat produk hasil reaksi mempunyai molaritas yang berbeda dari molaritas teoritis yang diharapkan. Hal ini terjadi karena reaksi sudah mencapai kondisi kesetimbangan kimia, yakni keadaan dimana zat pereaksi dan hasilnya terlihat seolah tidak berubah.
Reaksi Kesetimbangan Kimia
Reaksi disebut mencapai keadaan setimbang apabila zat-zat pereaksi dan zat-zat hasil reaksinya terdapat bersama-sama namun tidak ada perubahan reaksi yang bisa diamati. Artinya, campuran yang dihasilkan masih mengandung zat pereaksi awalnya namun reaksi seolah sudah berhenti.
Secara makroskopis reaksi seolah berhenti namun sebenarnya di tingkat mikroskopis atau tingkat molekul reaksi masih berlangsung. Pada kondisi ini dapat dikatakan bahwa campuran sudah mencapai keadaan setimbang (kesetimbangan). Oleh karena itu kesetimbangan kimia juga disebut kesetimbangan dinamis.
Secara umum, reaksi kesetimbangan kimia bisa dituliskan sebagai:
A + B ↔ C + D
Pergeseran Kesetimbangan Kimia
Apabila ada faktor dari luar sistem terhadap reaksi kimia, maka faktor tersebut akan membuat sistem keseimbangan memberikan aksi dalam rangka mengurangi pengaruh atas gangguan faktor luar tersebut.
Hal inilah yang diteliti oleh Henri Louis Le Chatelier yang menyimpulkan pengaruh faktor luar pada kesetimbangan kimia. Kesimpulan tersebut kemudian dirumuskan ke dalam asas yang disebut asas Le Chatelier berikut:
“Jika terhadap suatu kesetimbangan dilakukan suatu tindakan atau aksi, maka sistem tersebut akan memberikan reaksi yang cenderung mengurangi pengaruh dari aksi tersebut.” Singkatnya, asas Le Chatelier bisa dituliskan dengan persamaan berikut:
Reaksi = – Aksi
Reaksi yang diberikan sistem atas faktor luar adalah dengan melakukan pergeseran ke kiri atau ke kanan yang dikenal sebagai pergeseran kesetimbangan kimia.
- Kesetimbangan disebut bergeser ke arah kanan apabila jumlah produknya bertambah atau zat pereaksinya berkurang.
- Kesetimbangan disebut bergeser ke arah kiri apabila jumlah produknya berkurang atau zat pereaksinya bertambah.
Ada beberapa faktor yang menyebabkan terjadinya pergeseran kesetimbangan:
- Perubahan Konsentrasi
Sesuai dengan azas Le Chatelier yakni reaksi = – aksi, maka apabila konsentrasi salah satu komponennya diperbesar, reaksi dari sistemnya yakni mengurangi komponen tersebut. Sebaliknya, apabila salah satu komponen konsentrasinya dikurangi, maka sistem akan bereaksi dengan menambah komponen tersebut.
- Apabila konsentrasi pereaksi diperbesar maka kesetimbangan kimia akan bergeser ke arah kanan
- Apabila konsentrasi pereaksi diperkecil maka kesetimbangan kimia akan bergeser ke arah kiri
- Perubahan Volume dan Tekanan
Tekanan dan volume sangat berkaitan satu sama lainnya. Penambahan tekanan bisa dilakukan dengan cara mengurangi volume sehingga menyebabkan konsentrasi seluruh komponen meningkat. Berdasarkan azas Le Chatelier diketahui bahwa sistem akan bereaksi dengan mengurangi tekanan.
Tekanan gas tidak dipengaruhi oleh jenis gas namun bergantung kepada jumlah molekul. Oleh sebab itu, reaksi kesetimbangan kimia akan bergeser ke sisi dengan jumlah koefisien lebih kecil agar tekanan berkurang.
Sebaliknya, apabila tekanan diturunkan dengan cara menambah volumenya, maka sistem akan bereaksi meningkatkan tekanan dengan cara menambah jumlah molekul. Sehingga reaksi bergeser ke sisi dengan jumlah koefisien lebih besar.
Sebagai contoh pada reaksi kesetimbangan
3 H2 (g) + N2 (g) ↔2 NH3 (g)
Jumlah koefisien reaksi di bagian kiri = 3 + 1 = 4
Jumlah koefisien reaksi di bagian kanan = 2
- Apabila tekanan dikurangi (volume diperbesar), kesetimbangan reaksi akan bergeser ke sisi dengan jumlah koefisien paling besar.
- Apabila tekanan diperbesar (volume diperkecil), kesetimbangan reaksi akan bergeser ke sisi dengan jumlah koefisien paling kecil.
- Perubahan Suhu
Sebagaimana yang disimpulkan pada azas Le Chatelier, bahwa apabila suhu sistem kesetimbangan ditambah maka sistem akan bereaksi dengan menurunkan suhunya. Selanjutnya kesetimbangan reaksi akan bergeser ke sisi reaksi yang menyerap kalor yakni ke sisi reaksi endoterm.
Sebaliknya, apabila suhu diturunkan maka kesetimbangan reaksi akan bergeser ke sisi reaksi eksoterm.
- Apabila suhu dikurangi, maka kesetimbangan akan bergeser ke arah reaksi eksoterm yakni ke arah yang membebaskan kalor.
- Apabila suhu diperbesar, maka kesetimbangan akan bergeser ke arah reaksi endoterm yakni ke arah yang membutuhkan kalor
- Pengaruh Katalis
Penambahan katalis pada reaksi kimia akan memperbesar laju reaksi karena energi pengaktifan diturunkan. Energi pengaktifan yang berkurang berlaku dua arah. Sehingga disimpulkan bahwa katalis akan mempercepat laju reaksi balik dan juga laju reaksi maju.
Penggunaan katalis akan meningkatkan kecepatan reaksi mencapai kondisi setimbang. Katalis hanya mempercepat tercapainya kondisi setimbang namun tidak mengubah komposisi kesetimbangan.
- Pengaruh Komponen Padat dan Cair
Penambahan komponen baik berupa gas dan larutan akan mempengaruhi kerapatan antar partikel dalam campuran. Apabila ditambahkan komponen ke dalam campuran akan membuat konsentrasinya meningkat. Hal ini membuat sistem bereaksi dengan menurunkan konsentrasi.
Namun apabila zat yang ditambahkan adalah cairan murni atau padatan maka konsentrasi tidak berubah karena jarak antar partikel dalam cairan dan padatan tetap.
Tetapan Kesetimbangan
Menurut ilmuwan bernama Waage dan Cato Guldberg, harga tetapan kesetimbangan pada suhu tetap bernilai tetap.
Hukum Cato Guldberg dan Waage berbunyi bahwa dalam kondisi setimbang pada suhu tetap, hasil kali dari konsentrasi zat hasil reaksi dan dibagi hasil kali konsentrasi pereaksi sisa yang mana setiap konsentrasi dipangkatkan dengan koefisien reaksi bernilai tetap.
- Tetapan Kesetimbangan Konsentrasi (Kc)
Kc merupakan tetapan atau konstanta kesetimbangan konsentrasi yang nilainya tetap selama suhu tetap.
Untuk reaksi kesetimbangan di bawah ini:
m A + n B ↔ p C + q D
Persamaan tetapan kesetimbangannya yakni:
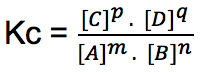
Oleh karena satuan konsentrasi adalah M, maka satuan:
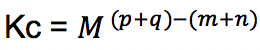
Keterangan:
[A], [B], [C], [D]: konsentrasi zat A, B, C, dan D dalam satuan molaritas atau mol/liter- Tetapan Kesetimbangan Tekanan (Kp)
Kp adalah tetapan atau konstanta kesetimbangan berdasarkan tekanan gas. Kp yakni hasil kali tekanan parsial gas-gas hasil reaksi kemudian dibagi oleh hasil kali dari tekanan parsial gas pereaksi. Selanjutnya setiap tekanan parsial gas dipangkatkan koefisiennya berdasarkan persamaan reaksi.
m A (g) + n B (g) ↔ p C (g) + q D (g)
Persamaan tetapan kesetimbangannya yakni:
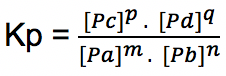
Pa, Pb, Pc, dan Pd adalah tekanan parsial dari gas terkait (atm) yang dihitung menggunakan rumus di bawah ini:
Pa = (mol a : mol total) x P total
Contoh Soal Kesetimbangan Kimia
Tentukan persamaan tetapan kesetimbangan (Kp) reaksi di bawah ini:
N2 (g) + 3 H2 (g) ↔2 NH3 (g)
Jawab:
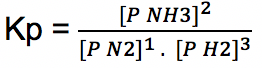
Dalam reaksi kimia, dikenal istilah reaksi dapat balik (reversible) yakni reaksi yang berlangsung dalam dua arah. Jika dalam suatu reaksi kimia kecepatan reaksi ke sisi kiri sama kecepatannya dengan reaksi ke kanan maka reaksi dikatakan dalam kondisi kesetimbangan kimia.