Dalam setiap botol sebuah larutan seperti larutan cuka makan tentu tercantum keterangan mengenai kadar asam pada cuka makan tersebut. Untuk menetapkan konsentrasi atau kadar sebuah larutan baik itu larutan asam atau basa, maka harus dilakukan metode titrasi asam basa.
Pengertian Titrasi Asam Basa
Titrasi asam basa adalah suatu metode percobaan yang digunakan untuk menetapkan kadar larutan asam dan juga basa dari suatu larutan. Titrasi merupakan istilah yang bermakna penetapan kadar atau titer. Prosedur titrasi asam basa adalah titrasi yang didasarkan kepada reaksi penetralan asam basa.
Larutan asam ditentukan kadarnya menggunakan larutan basa yang sudah diketahui sebelumnya kadarnya. Sementara untuk mengukur kadar larutan basa digunakan larutan asam yang sudah diketahui kadarnya.
Prosedur Titrasi Asam Basa
Untuk memahami bagaimana prosedur titrasi asam basa bisa dimisalkan dengan contoh eksperimen untuk menentukan kadar larutan HNO3 dengan menggunakan larutan basa KOH 0,1 M. Hal yang harus dicari adalah berapa volume larutan KOH yang ekuivalen dengan volume tertentu dari larutan HNO3.
Caranya adalah dengan menempatkan sebagian dari volume larutan HNO3 tersebut pada labu Erlenmeyer. Misalkan diambil sebanyak 20 mL selanjutnya ditetesi oleh larutan KOH 0,1 M di dalam buret sehingga kedua larutan tersebut ekivalen atau tepat habis bereaksi.
Untuk mengetahui pada titik manakah keduanya ekivalen dengan memakai bantuan indikator. Eksperimen titrasi atau penetesan dihentikan tepat ketika indikator memperlihatkan perubahan warna. Ketika indikator memperlihatkan perubahan warna maka pada saat itu mencapai “titik akhir titrasi”.
Patut dipahami 2 kondisi berikut saat melakukan prosedur titrasi asam basa:
- Titik Ekivalen: titik dimana nilai pH pada saat asam serta basa tepat ekivalen.
- Titik Akhir Titrasi: titik nilai pH saat indikator berubah warna
Keakuratan eksperimen titrasi asam basa bisa dioptimalkan dengan cara mencari titik akhir titrasi yang paling dekat dengan titik ekivalen.
Untuk mendapatkan nilai titik akhir titrasi yang paling mendekati titik ekivalen, maka harus menggunakan indikator yang sangat sensitif dan mengalami perubahan warna di sekitar titik ekivalen.
Nilai pH yang Berubah pada Titrasi Asam Basa (Kurva Titrasi)
Apabila larutan asam dengan pH kurang dari 7 kemudian ditetesi oleh larutan basa dengan pH lebih dari 7 maka pH larutan asam tersebut akan meningkat. Sementara larutan basa ditetesi oleh larutan asam akan membuat pH menurun. Grafik yang menunjukkan perubahan pH saat titrasi asam basa disebut kurva titrasi.
Bentuk kurva titrasi asam basa sangat bergantung kepada kekuatan larutan asam dan larutan basa yang direaksikan. Setidaknya ada 3 jenis titrasi yang biasa dilakukan:
- Titrasi asam kuat dengan basa kuat
- Titrasi asam lemah dengan basa kuat
- Titrasi basa lemah dengan asam kuat
1. Titrasi Asam Kuat dengan Basa Kuat
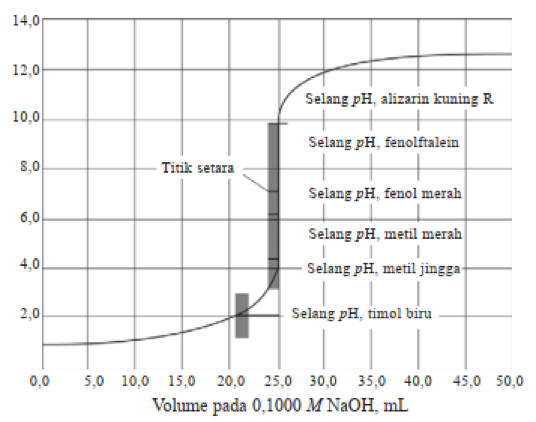
Pada Gambar 1 di atas merupakan kurva titrasi 25 mL HCl 0,1 M yang merupakan asam kuat selanjutnya dititrasi dengan basa kuat NaOH 0,1 M. Selama berlangsungnya proses titrasi tampak pH larutan terus berubah ke bermacam-macam titik.
Ciri penting dari kurva titrasi adalah NaOH dan HCl adalah nilai pH akan terus berubah pada awalnya secara lambat hingga mencapai dekat ke titik ekivalen. Saat mencapai titik ekivalen, maka pH meningkat secara tajam hingga 6 titik yakni dari pH 4 hingga pH 10 dengan hanya meneteskan 0,1 mL.
Setelah melewati titik ekivalen, nilai pH berubah secara lambat meski terus ditetesi larutan NaOH. Sebagai catatan, indikator pH yang harus digunakan adalah indikator yang memiliki trayek pH pada bagian terjal kurva yakni dari 4 hingga 10.
Ada beberapa jenis indikator yang bisa digunakan yakni metil merah, brom timol biru hingga fenolftalein (PP). Pada titrasi asam kuat dengan basa kuat, nilai pH adalah ketika titik ekivalen 7. Pada nilai pH ini asam kuat seluruhnya tepat habis bereaksi dengan larutan basa kuat sehingga membentuk garam netral.
2. Titrasi Asam Lemah dengan Basa Kuat
Reaksi titrasi asam lemah dengan basa kuat sedikit berbeda dengan titrasi asam kuat sebelumnya. Contoh asam lemah adalah CH3COOH 0,1 M sebanyak 25 mL yang dititrasi dengan basa kuat NaOH 0,1 M. Pada awalnya sebagian besar asam lemah pada larutan dalam bentuk molekul tak mengion.
Saat dilakukan titrasi oleh basa kuat, maka proton dialihkan langsung dari sebelumnya berbentuk molekul CH3COOH tidak mengion menjadi OHˉ. Penetralan CH3COOH oleh larutan basa kuat NaOH melalui reaksi kimia berikut ini:
CH3COOH (aq) + OHˉ (aq) → H2O (l) + CH3COOˉ (aq)
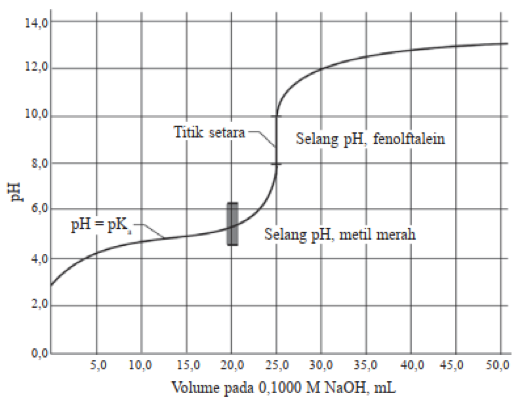
Ada beberapa sifat penting yang terkait dengan titrasi asam lemah oleh basa kuat:
- Awal titrasi asam lemah oleh basa kuat mempunyai nilai pH yang lebih tinggi dibandingkan titrasi asam kuat dengan basa kuat
- Terjadi peningkatan pH sedikit tajam di awal titrasi. Ion CH3COOˉ yang dihasilkan pada reaksi penetralan akan menekan pengionan asam asetat
- Sebelum mencapai titik ekivalen, pH berubah secara perlahan. Pada bagian dari kurva titrasi sebelum mencapai titik ekivalen ini mengandung banyak senyawa CH3COOH dan CH3COOˉ. Larutan ini adalah larutan penyangga
- Nilai pH di titik saat asam lemah setengah dinetralkan adalah pH – pKa yang mana saat setengah penetralan [CH3COOH] = [CH3COOˉ]
- Nilai pH di titik ekivalen lebih besar dari 7 yakni di sekitar 8,9 yang merupakan hasil hidrolisis CH3COOˉ.
- Setelah mencapai titik ekivalen, kurva titrasi asam lemah dengan basa kuat hampir mirip dengan kurva titrasi asam kuat dengan basa kuat. Pada kondisi setelah titik ekivalen, nilai pH ditentukan oleh kadar OHˉ bebas
- Garis terjal pada kurva titrasi pada titik ekivalen terjadi pada selang pH sempit yakni sekitar 7 hingga 10
- Pemilihan indikator yang cocok digunakan lebih terbatas yakni fenolftalein (PP) dengan trayek pH antara 7 sampai 10.
3. Titrasi Basa Lemah dengan Asam Kuat
Apabila basa lemah NH4OH 0,1 M sebanyak 25 mL dititrasi menggunakan asam kuat HCl 0,1 M, akan membuat besar pH menurun sedikit demi sedikit. Selanjutnya pH akan menurun secara drastis pada rentang pH antara 4 hingga 7. Titik ekivalen berada di pH < 7. Indikator yang digunakan adalah metil merah.
Contoh Soal Titrasi Asam Basa
Diketahui larutan NH4OH sebanyak 25 mL dititrasi menggunakan larutan HF 0,1 M sebanyak 100 mL. Tentukan konsentrasi NH4OH
Jawab:
V1 x M1 x n1 = V2 x M2 x n2
M2 = 100 mL x 0,1 M x 1 / (25 mL x 1)
M2 = 0,4
Kesimpulan
Titrasi asam basa merupakan cara untuk mengetahui kadar larutan asam dan juga basa dari suatu larutan. Prosedur titrasi asam basa adalah titrasi yang didasarkan kepada reaksi penetralan asam basa. Prosedur titrasi harus langsung dihentikan tepat ketika indikator berubah warna karena dekat dengan titik ekivalen.
