Seperti yang sudah diketahui bahwa sifat-sifat setiap unsur sangat bergantung kepada elektron valensinya. Keberadaan elektron memainkan peranan penting dalam pembentukan ikatan kimia. Di alam sendiri ada berbagai jenis ikatan kimia, seperti ikatan hidrogen yang merupakan ikatan kimia dengan atom hidrogen.
Definisi Ikatan Hidrogen
Ada berbagai jenis ikatan kimia yang membentuk bermacam-macam senyawa di alam baik itu senyawa alami ataupun senyawa buatan seperti ikatan ion atau ikatan elektrokovalen, ikatan logam, ikatan kovalen, dan ikatan kovalen koordinat.
Ikatan hidrogen termasuk ke dalam salah satu ikatan kimia yang memiliki gaya antar molekul lebih kuat dibandingkan kebanyakan gaya antar molekul lainnya, namun ikatan hidrogen memiliki kekuatan yang relatif jauh lebih lemah dibandingkan ikatan ion dan ikatan kovalen.
Ikatan kovalen adalah ikatan kimia yang membentuk senyawa dari sesama unsur non logam. Sementara ikatan ion atau ikatan elektrovalen adalah ikatan yang membentuk gaya tarik-menarik listrik antara ion-ion dengan muatan berbeda.
Ikatan hidrogen terbentuk karena adanya gaya tarik menarik antara atom hidrogen yang sangat positif dan terikat pada atom dengan elektronegatifan besar seperti O, N dan F kemudian saling berikatan kovalen dalam molekul yang sama atau pada molekul lain.
Oleh karena itu ikatan hidrogen memiliki ikatan lebih lemah dibandingkan ikatan kovalen yang terbentuk dari pembagian elektron dari 2 atom. Keberadaan ikatan hidrogen berpengaruh terhadap titik didih suatu senyawa.
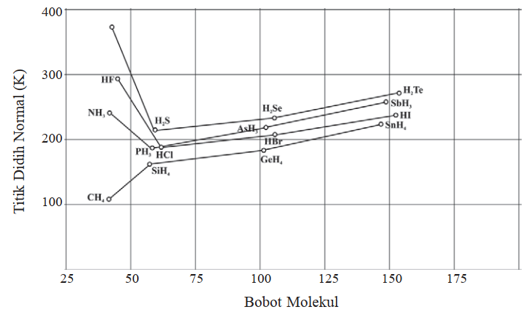
Bisa dilihat pada Gambar 1 di atas bahwa semakin besar massa molekul, maka titik didih senyawa hidrida dari unsur golongan IV A meningkat. Namun terlihat adanya keanehan pada tiga senyawa yakni HF, NH3, H2O. Ketiga senyawa ini memiliki titik didih yang sangat tinggi dibandingkan senyawa dari kelompoknya.
Ketiga senyawa ini memiliki sifat polar, namun kenaikan titik didih sangat mencolok ini bukan karena gaya dipol-dipol antar molekul karena gaya tersebut tidak cukup kuat. Titik didih yang sangat tinggi ini disebabkan oleh ikatan hidrogen pada molekul tersebut.
Apabila ikatan hidrogen semakin panjang, maka titik didih senyawa tersebut semakin tinggi. Kekuatan dari ikatan hidrogen dipengaruhi oleh perbedaan elektronegativitas dari selang atom-atom di dalam molekul. Apabila perbedaan semakin besar maka ikatan hidrogen yang terbentuk semakin besar.
Ikatan hidrogen juga lebih kuat dibandingkan gaya van der Waals. Energi yang diperlukan agar bisa memutuskan ikatan hidrogen yaitu 15 hingga 40 kJ/mol. Jumlah energi yang dibutuhkan untuk memutuskan gaya van der Waals jauh lebih besar dibandingkan gaya van der Waals yang hanya 2 sampai 20 kJ/mol
Sifat-Sifat Senyawa Ikatan Hidrogen
- Ikatan hidrogen terbentuk antara senyawa hidrogen dengan unsur yang memiliki nilai keelektronegatifan besar yakni Oksigen (O), Nitrogen (N) dan Flourin (F). Contoh senyawa dari ikatan hidrogen adalah NH3, H2O, dan HF.
- Titik didih pada senyawa berikatan hidrogen relative lebih tinggi dibandingkan senyawa lainnya yang sejenis di kelompoknya. Misalnya titik didih senyawa berikatan hidrogen HF lebih tinggi dibandingkan HI padahal atom I memiliki massa molekul relative yang lebih besar dibanding F. Hal ini dikarenakan adanya gaya ikatan hidrogen antara molekul.
- Ikatan hidrogen ada pada senyawa yang mengandung ikatan O – H, F – H dan N – H. Sifat ikatan yang terbentuk sangat polar karena adanya perbedaan keelektronegatifan yang sangat besar.
- Senyawa dengan ikatan hidrogen memiliki titik cair yang relative lebih tinggi
Ikatan Hidrogen di Makhluk Hidup
Di dalam tubuh makhluk hidup terdapat berbagai senyawa yang mempunyai struktur kompleks seperti senyawa DNA dan protein. Pada senyawa ini terdapat ikatan hidrogen yang bisa dengan mudah diputuskan dan kemudian terbentuk kembali.
Ikatan hidrogen berpengaruh terhadap bentuk molekul protein. Ikatan hidrogen pada DNA berfungsi mengikatkan kedua untai molekul DNA dan membentuk suatu heliks ganda.
Jenis-Jenis Ikatan Hidrogen
- Ikatan Hidrogen Intermolekul
Ikatan hidrogen intermolekul adalah ikatan kimia yang terbentuk dari dua buah molekul dari senyawa yang sama maupun senyawa yang berbeda. Molekul-molekul dari senyawa yang berbeda dan sama akan dipolimerisasikan maupun diasosiasikan.
Beberapa senyawa di kehidupan sehari-hari yang merupakan ikatan hidrogen intermolekul adalah air, alkohol, amonia, es dan juga hidrogen fluorida.
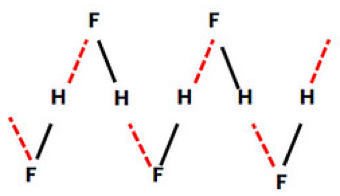
Gambar 2 di atas adalah contoh ikatan hidrogen intermolekul yang ada pada senyawa hidrogen fluoride (HF). Gambar tersebut menunjukkan rantai zig-zag panjang yang saling dihubungkan oleh ikatan hidrogen pada senyawa hidrogen fluorida terjadi saat senyawa dalam kondisi padat.
Ikatan hidrogen intermolekul juga terjadi pada senyawa air atau H2O yang mana atom pusat berupa oksigen dikelilingi secara empat arah atau tetrahedral oleh 4 buah atom hidrogen.
- Ikatan Hidrogen Intramolekul
Ikatan hidrogen intramolekul terbentuk di dalam molekul yang sama antara atom hidrogen beserta beberapa atom elektronegatif yang lainnya yakni atom oksigen, nitrogen dan fluor. Ikatan hidrogen intramolekul terbentuk dari siklisisasi molekul.
Ikatan hidrogen intramolekul banyak ditemukan pada senyawa organik. Contoh pada gambar 3 di bawah adalah senyawa o – Nitrofenol yang merupakan senyawa hidrogen intramolekul.

Contoh Soal Konfigurasi Hidrogen
Tentukan dari senyawa-senyawa di bawah ini yang manakah yang memiliki ikatan hidrogen.
a. CH3F
b. HCl
c. NH3
d. H2O
e. CH3OH
f. NOH
g. CH3NH2
h. CHCl3
Jawab:
a. CH3F: Pada senyawa ini tidak terdapat ikatan hidrogen yang terbentuk karena atom F berikatan dengan atom C pada ikatan C – F dan bukan membentuk ikatan F – H
b. HCl: Pada senyawa ini tidak terdapat ikatan hidrogen yang terbentuk karena atom H berikatan dengan atom Cl dan bukan atom N, O dan F.
c. NH3: Pada senyawa ini terdapat ikatan hidrogen yang terbentuk antara atom N berikatan dengan atom H
d. H2O: Pada senyawa ini terdapat ikatan hidrogen yang terbentuk antara atom O berikatan dengan atom H
e. CH3OH: Pada senyawa ini terdapat ikatan hidrogen yang terbentuk antara atom O berikatan dengan atom H pada ikatan O – H
f. NOH: Pada senyawa ini terdapat ikatan hidrogen yang terbentuk antara atom O berikatan dengan atom H pada ikatan O – H
g. CH3NH2: Pada senyawa ini terdapat ikatan hidrogen yang terbentuk antara atom N berikatan dengan atom H pada ikatan N – H
h. CHCl3: Pada senyawa ini tidak terdapat ikatan hidrogen yang terbentuk karena atom H berikatan dengan atom C padahal untuk membentuk ikatan hidrogen atom H harus berikatan dengan atom N, O atau atom F.
Penutup
Ikatan hidrogen merupakan jenis ikatan kimia yang lebih lemah gaya tarik-menarik antar atomnya dibandingkan ikatan kovalen yang terbentuk dari pembagian elektron antara 2 atom. Ikatan hidrogen berpengaruh terhadap titik didih dari sebuah senyawa.
