Senyawa karbon merupakan senyawa yang sangat melimpah di alam bahkan jumlahnya jauh melampaui jumlah senyawa yang tidak mengandung unsur karbon. Atom karbon sendiri memiliki karakteristik yang istimewa yang setiap jenis senyawa karbon terbentuk mempunyai reaksi senyawa karbon yang berbeda.
Ikatan Atom Karbon dan Senyawa Hidrokarbon
Atom karbon memiliki keistimewaan yakni mempunyai 4 elektron valensi. Keistimewaan ini menguntungkan karena atom karbon hanya cukup membentuk 4 ikatan kovalen jika ingin mencapai kestabilan. Karbon dapat membentuk ikatan kovalen yang cukup kuat dengan berbagai unsur nonlogam.
Beberapa unsur yang mudah berikatan kovalen dengan karbon adalah unsur hidrogen (H), oksigen (O), golongan halogen (F, Cl, Br, I) serta unsur nitrogen (N). Karbon juga bisa berikatan kovalen dengan unsur logam seperti magnesium.
Ikatan kovalen yang terbentuk antara atom karbon dengan unsur lainnya dapat membentuk ikatan tunggal, ikatan rangkap serta ikatan rangkap 3. Atom karbon juga bisa membentuk rantai siklik atau lingkar. Karena jenis ikatan yang terbentuk banyak, membuat jumlah senyawa karbon di alam sangat banyak.
Salah satu golongan senyawa karbon yang paling banyak terbentuk adalah hidrokarbon yang terdiri dari unsur karbon (C) dan unsur hidrogen (H). Secara umum, jenis-jenis senyawa hidrokarbon yang banyak di alam yakni:
- Senyawa alkana adalah hidrokarbon alifatik jenuh yakni hidrokarbon yang mempunyai rantai terbuka dengan semua ikatan karbon adalah ikatan tunggal.
- Senyawa alkena termasuk ke dalam hidrokarbon alifatik tidak jenuh yang memiliki satu ikatan rangkap karbon C, -C = C-.
- Senyawa alkuna adalah senyawa hidrokarbon alifatik tidak jenuh yang memiliki satu ikatan karbon-karbon rangkap 3 yakni – C ≡ C –
Ketiga senyawa hidrokarbon di atas memiliki reaksi senyawa karbon berbeda-beda.
Jenis-Jenis Reaksi Senyawa Karbon Alkana
Senyawa karbon alkana termasuk ke dalam zat yang sulit untuk bereaksi sehingga disebut sebagai parafin yang memiliki arti afinitas kecil. Beberapa reaksi senyawa karbon yang dialami oleh alkana adalah reaksi pembakaran, substitusi serta perengkahan atau cracking.
- Pembakaran
Alkana bisa mengalami oksidasi dengan gas oksigen. Reaksi pembakaran senyawa alkana akan selalu menghasilkan energi. Oleh karena itu senyawa alkana menjadi sumber berbagai kebutuhan bahan bakar seperti elpiji, kerosin, bensin dan solar.
Rata-rata jumlah energi yang dihasilkan dari oksidasi 1 gram senyawa alkana sebanyak 50.000 Joule. Alkana akan mengalami pembakaran sempurna yang menghasilkan senyawa CO2 dan H2O. Contoh reaksi pembakaran alkana pada senyawa propana di bawah ini:
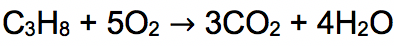
Reaksi pembakaran sempurna senyawa metana:
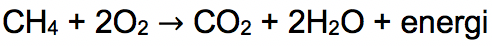
Sementara pembakaran tidak sempurna senyawa alkana akan menghasilkan CO dengan H2O atau jelaga yang merupakan partikel karbon.
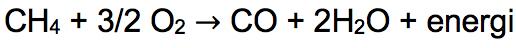
- Substitusi atau Pergantian
Senyawa alkana juga bisa mengalami reaksi substitusi apabila direaksikan dengan unsur-unsur golongan halogen seperti F2, Br2, Cl2, dan I2. Pada reaksi substitusi senyawa alkana, maka atom H dari alkana akan digantikan oleh atom lainnya, terutama atom halogen.
Penggantian atom H oleh atom atau gugus lainnya disebut sebagai reaksi substitusi. Reaksi substitusi senyawa alkana dengan atom golongan halogen disebut halogenasi yakni reaksi penggantian atom H dari alkana dengan atom halogennya misal klorin.
Contoh alkana direaksikan dengan atom klorin maka akan terjadi reaksi klorinasi.
CH4 + Cl2 → CH3Cl (metilklorida atau klorometana) + HCl
CH3Cl + Cl2 → CH2Cl2 (diklorometana) + HCl
CH2Cl2 + Cl2 → CHCl3 (kloroform atau triklorometana) + HCl
CHCl3 + Cl2 → CCl4 (karbon tetraklorida) + HCl
Jenis-Jenis Reaksi Senyawa Karbon Alkena
Alkena memiliki sifat yang lebih reaktif dibandingkan senyawa alkana.
- Pembakaran
Reaksi pembakaran senyawa alkena merupakan reaksi oksidasi alkena terhadap gas oksigen (O2). Alkena suku rendah juga mudah terbakar sebagaimana senyawa alkana.
CH2 = CH2 (g) + 3O2 → 2CO2 (g) + 2H2O (g)
Apabila senyawa alkena dibakar di udara terbuka, maka senyawa ini akan menghasilkan jumlah jelaga yang lebih banyak dibandingkan alkana. Alkena menghasilkan jelaga lebih banyak karena kadar karbonnya yang lebih tinggi daripada alkana. Oleh karena itu pembakaran alkena membutuhkan lebih banyak oksigen.
Apabila senyawa alkena mengalami pembakaran sempurna maka akan dihasilkan gas CO2 dan uap air.
- Reaksi Adisi (Penambahan = Penjenuhan)
Reaksi adisi merupakan reaksi pengubahan ikatan tidak jenuh atau rangkap menjadi ikatan jenuh (tunggal) dengan menangkap atom lainnya. Reaksi adisi adalah reaksi paling penting dari senyawa alkena.
- Reaksi Adisi dengan Hidrogen (Hidrogenasi)
Senyawa alkena bereaksi dengan atom hidrogen akan membentuk alkana di suhu berkisar 150 – 200 ⁰C dengan menggunakan katalis logam.
CH2 = CH2 + H2 → CH3 – CH3, katalis Pt/Ni yakni zat untuk mempercepat reaksi
- Reaksi Adisi Klorin pada Propena
Senyawa propena bereaksi dengan klorin akan menghasilkan 1,2 – dikloropropana.
- Reaksi Adisi HCL pada Propena
Senyawa propena bereaksi dengan HCl menghasilkan 2 – kloropropana
- Reaksi Hidrasi Alkena dengan Air Membentuk Alkohol
- Reaksi Hidrasi Asam Halida dengan Alkena
Senyawa asam halida meliputi HCl, HF, HBr, dan HI apabila direaksikan dengan senyawa alkena maka berlaku pada senyawa ini aturan Markovnikov. Aturan Markovnikov menyatakan bahwa atom H dari asam halida akan terikat ke atom C yang berikatan rangkap yang mempunyai lebih banyak atom H.
Contoh di bawah ini adalah reaksi senyawa propena dengan asam klorida menghasilkan senyawa 2 – kloropropena.
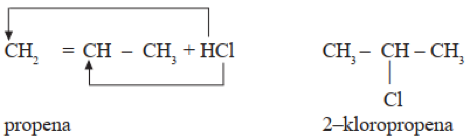
- Polimerisasi
Polimerisasi merupakan reaksi penggabungan molekul sederhana yang membentuk molekul lebih besar. Molekul-molekul sederhana yang mengalami reaksi polimerisasi disebut sebagai monomer sementara hasil dari reaksi polimerisasi adalah polimer. Molekul alkena pada reaksi polimerisasi akan saling menjenuhkan.
Jenis-Jenis Reaksi Senyawa Karbon Alkuna
Sebagaimana alkena, senyawa alkuna juga mudah bereaksi karena memiliki ikatan rangkap. Namun, karena senyawa alkuna memiliki ikatan rangkap tiga maka untuk menjenuhnya ikatan rangkap senyawa alkuna memerlukan pereaksi dengan jumlah dua kali lebih banyak dibandingkan pereaksi untuk alkena.
Reaksi penjenuhan senyawa alkuna dengan hidrogen akan membentuk senyawa alkana. Berikut adalah contoh reaksi etuna dengan gas hidrogen menghasilkan etana.
H – C ≡ C – H + 2H2 → C2H6
Contoh Soal Reaksi Senyawa Karbon
Buatlah gambaran reaksi pembakaran alkena dengan gas oksigen baik pembakaran sempurna dan pembakaran tidak sempurna.
Jawab:
a. Reaksi pembakaran sempurna:
C2H4 + 3O2 → 2CO2 (g) + 2H2O (g)
b. Reaksi pembakaran tidak sempurna:
C2H4 + 2O2 → 2CO (g) + 2H2O (g)
Kesimpulan
Senyawa karbon memiliki kelimpahan yang sangat besar di alam karena adanya keistimewaan ikatan-ikatan antara atom karbon dan unsur lainnya. Beberapa reaksi senyawa karbon yang penting untuk dipelajari adalah reaksi senyawa hidrokarbon berupa alkana, alkena dan alkuna.
