Dalam kehidupan sehari-hari, manusia akan selalu berhubungan dengan gas di sekitar. Dalam ilmu sains, gas dianggap bersifat ideal yang merupakan fluida bergerak yang akan langsung menempati ruangnya secara tersebar merata. Perilaku gas ketika berada di suatu sistem dipelajari dalam teori kinetik gas.
Pengertian Teori Kinetik Gas
Teori kinetik gas memberi jembatan untuk melakukan tinjauan terhadap karakteristik gas baik secara makroskopik maupun mikroskopik. Kata kinetik menunjukkan bahwa molekul atau partikel gas akan selalu bergerak.
Hal ini menunjukkan bahwa sifat gas ketika menempati ruang akan bergerak secara acak ke segala arah. Besaran makroskopik yang dimiliki oleh gas meliputi suhu, volume dan tekanan. Seluruh besaran makroskopik tersebut bisa diukur di dalam laboratorium.
Sementara besaran mikroskopik dari gas terdiri dari momentum molekul, laju molekul, dan energi kinetik molekul. Besaran mikroskopik tidak bisa diukur secara langsung hanya di laboratorium namun besaran mikroskopik bisa dihitung.
Gas yang umum dipelajari adalah hukum gas ideal yang secara tepat memenuhi hukum-hukum gas. Gas ideal sendiri adalah gambaran gas yang sesuai teori, sementara di kehidupan sehari-hari tidak ada gas yang memenuhi karakteristik gas ideal.
Beberapa karakteristik gas ideal yakni partikel gas tersebut tersebar secara merata di dalam ruangan dan bergerak secara acak ke segala arah.
Dalam teori kinetik gas berbunyi bahwa pada sistem yang panas, partikel gas akan bergerak lebih cepat sehingga mempunyai energi yang lebih besar dibandingkan partikel gas di dalam sistem bersuhu lebih rendah.
Postulat Teori Kinetik Gas
Gas ideal adalah kumpulan dari partikel suatu zat yang antar partikelnya memiliki jarak cukup jauh dibandingkan dengan ukuran dari partikel gas tersebut. Partikel pada gas ideal dirumuskan dengan postulat teori kinetik gas sebagai berikut:
- Partikel pada gas ideal selalu bergerak secara acak ke berbagai arah
- Partikel-partikel gas ideal akan saling bertumbukan baik antar partikel maupun bertumbukan dengan dinding maka akan tercipta tumbukan lenting sempurna yang membuat gas ideal tidak kehilangan energi
- Partikel gas ideal berjumlah banyak
- Antar partikel gas tidak mengalami interaksi atau tidak tercipta gaya tarik menarik antar partikel
- Ukuran partikel gas ideal yang sangat kecil jika dibandingkan dengan ukuran ruangan dapat diabaikan
- Partikel gas idal tersebar secara merata di dalam ruangan
- Hukum Newton tentang gerak berlaku pada gerak kinetik gas
- Energi kinetik rata-rata dari molekul gas ideal nilainya sebanding dengan suhu mutlak dari gas ideal tersebut
Faktor dan Rumus Teori Kinetik Gas
- Tekanan
Tekanan gas dalam suatu sistem dapat diubah dengan mengatur volume dan suhu sistem tersebut. Hubungan antara tekanan, suhu dan volume ini bisa dilihat dari pemanfaatan alat masak Preswere Cooler (Presto).
Presto memasak makanan dengan memanfaatkan tekanan gas di dalamnya yang diatur melalui suhu dan volume gas. Terkait tekanan gas ini dijelaskan di dalam hukum Boyle – Guy Lussac. Boyle meneliti kondisi tekanan dan volume gas dengan membuat suhu gas tetap.
Dari hasil penelitian didapat bahwa ketika tekanan gas ditambah maka volume gas mengecil. Sebaliknya saat volume diperbesar, maka tekanan gas mengecil. Sehingga dapat dirumuskan bahwa pada suhu yang tetap, maka tekanan gas berbanding terbalik dengan volume.
PV = tetap
Sementara Guy Lussac meneliti bahwa jika gas memiliki tekanan tetap, maka volume nilainya sebanding dengan suhu. Saat suhu meningkat maka volume juga meningkat.
V/T = tetap
Sehingga disimpulkan persamaan tekanan pada teori kinetik gas adalah:
PV/T = tetap
- Suhu dan Energi Kinetik
Untuk mengetahui suhu gas dan hubungannya dengan energi kinetik, maka dapat terlihat bahwa ketika ban dipompa dari luar, maka jumlah partikel gas di dalam ban bertambah. Saat partikel bertambah maka tekanan membesar sementara volume serta suhu gas tetap. Sehingga didapat:
PV = NkT
Keterangan:
P = Tekanan gas (Pa)
V = Volume gas (m³)
N = Jumlah partikel
k = 1,38 x 10ˉ²³ J/K
T = Suhu gas (K)
Untuk gas berjenis monoatomic, maka partikel gas tersebut mempunyai tiga derajat kebebasan. Untuk menghitung energi kinetik rata-rata partikel menggunakan persamaan berikut:
Fk = 3/2 x k x T
Menghitung jumlah semua energi kinetik dari banyak partikel gas dengan rumus berikut:
U = 3/2 x N x k x T atau U = 3/2 x n x R x T
- Banyak Tumbukan dengan Dinding
Untuk menghitung berapa jumlah tumbukan atom dengan dinding wadah gas setiap satuan luas per satuan waktu bisa menggunakan persamaan berikut dengan anggapan gas berkarakteristik ideal:
A = N x vavg/4 V
- Laju RMS Molekul
Kecepatan rata-rata dari partikel gas sebanding dengan nilai akar dari suhu mutlak gas. Akar kuadrat persamaan rata-rata dikenal sebagai laju RMS atau laju akar perata kuadrat (root mean square) atau kecepatan efektif dengan rumus:
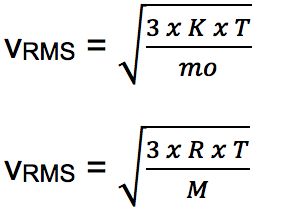
Teori Kinetik Gas dalam Kehidupan Sehari-Hari
- Merebus Air
Merebus air adalah salah satu aplikasi dari teori kinetik gas dalam kehidupan sehari-hari. Amati bagaimana kondisi air di dalam wadah rebus air saat awal kompor dinyalakan. Saat awal air diam namun ketika mendidih maka pada air terbentuk gelembung-gelembung udara.
Saat awal memasak, air dalam kondisi stabil dan belum terjadi perpindahan panas. Saat mendidih maka partikel air bergerak cepat dikarenakan panas merambat dari kompor. Selanjutnya teko berbunyi ketika mendidih karena perubahan tekanan.
- Es Batu
Es batu yang baru dikeluarkan dari lemari es akan terasa sangat dingin. Namun, es batu lama-kelamaan akan mencair ketika diletakkan di ruang bersuhu kamar. Hal ini terjadi disebabkan oleh suhu es dipengaruhi oleh suhu lingkungan dan mengalami perpindahan kalor ke es batu dari lingkungan.
Contoh Soal Teori Kinetik Gas
Pada silinder yang volumenya bisa diubah-ubah dengan menaik turunkan tutupnya, awalnya mempunyai volume 1,5 L. Tekanan lalu diukur sebesar 1 atm dengan suhu sebesar 27 ⁰C. Ketika tutup tabung ditekan maka tekanan gas meningkat menjadi 1,2 atm sementara volume menurun jadi 1,2 L. Tentukan suhunya?
Diketahui:
V1 = 1,5 L
P1 = 1 atm
T1 = 27 ⁰C + 273 = 300 K
V2 = 1,2 L
P2 = 1,2 atm
Ditanya:
Suhu T2?
Jawab:
P1.V1/T1 = P2.V2/T2
(1 x 1,5)/300 = (1,2 x 1,2)/T2
T2 = 288 K
T2 = 288 – 273 = 15 ⁰C
Dengan mempelajari teori kinetik gas, diharapkan kita dapat memahami pengertian dari gas ideal serta mampu menerapkan ilmu teori kinetik gas dan persamaan gas ideal pada proses isotermik, isobarik dan isokhorik dalam kehidupan sehari-hari.
